Creación de recursos en Ciencias
Manos a la obra
Resuelve las siguientes actividades:
1. Una estudiante analizó una muestra suero bovino para determinar la cantidad de proteínas presentes por el método de biuret.
Primeramente realizó un barrido espectral para determinar la longitud máxima de absorción utilizando un método gráfico.
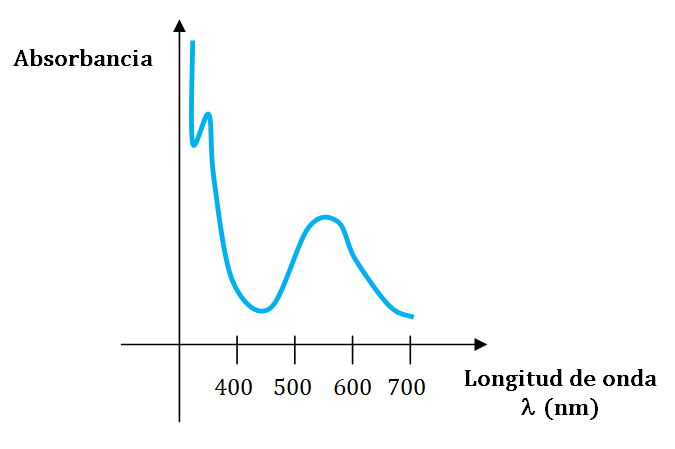
Espectro de absorción del complejo proteína - ion cobre (II)
- ¿Cómo determinarías la longitud máxima de absorción? Recuerda que el espectrofotómetro con el que se cuenta en el laboratorio funciona en el rango del visible.
- ¿Por qué es necesario el reactivo de biuret para determinar la cantidad de proteína en la muestra?
- Escribe la ecuación de formación del complejo coloreado.
- ¿Qué necesitarías (productos químicos, instrumentos y materiales) para preparar la solución patrón para obtener la curva de calibración?
- La estudiante obtuvo los siguientes datos:
| Concentración C (g/L) |
2,0652 | 4,1304 | 6,1956 | 8,2608 | 10,3260 | Problema |
|---|---|---|---|---|---|---|
Absorbancia |
0,105 | 0,216 | 0,318 | 0,383 | 0,456 | 1,417 |
- Construye la gráfica de absorbancia versus concentración.
- Determina la curva de mejor ajuste.
- Determina el coeficiente de correlación de Pearson (R2). ¿Para qué es útil este valor?
- ¿Cuál es la concentración de la solución problema expresada en g/L?
- Otra forma de dosificar proteínas es por el método de Bradford. ¿Qué diferencias, ventajas y desventajas presenta frente al método de biuret?
2. El catión hierro (II) o ferroso forma un complejo con la 1,10-fenantrolina cuyo máximo de absorción se da λ = 510 nm. A partir de una solución patrón de hierro se preparó una curva de calibración, obteniéndose los siguientes datos:
|
C (mg/L) |
Absorbancia |
|---|---|
|
2,000 |
0,160 |
|
4,000 |
0,313 |
|
6,000 |
0,460 |
|
8,000 |
0,619 |
| Problema | 0,203 |
Se toman 25,00 mL de una muestra de agua subterránea y se colocan en un matraz aforado de 50,00 mL (dilución al medio) después de ser tratada para formar el complejo coloreado. Calcula la concentración de Fe2+ de la muestra de agua expresada en ppm.
3. La
concentración máxima del herbicida 3-aminotriazol (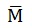 = 84 g/mol) presente en
alimentos es de 0,05 ppm. Dicho compuesto se determina
mediante una reacción colorimétrica (método de Galoux). A partir de
3-aminotriazol calidad ppa se construyó la siguiente curva de calibración
empleando una celda de 1 cm:
= 84 g/mol) presente en
alimentos es de 0,05 ppm. Dicho compuesto se determina
mediante una reacción colorimétrica (método de Galoux). A partir de
3-aminotriazol calidad ppa se construyó la siguiente curva de calibración
empleando una celda de 1 cm:
| Concentración C (g/L) | 0,05 | 0,10 | 0,15 | 0,20 | 0,25 | 0,38 |
|---|---|---|---|---|---|---|
Absorbancia | 0,02 | 0,04 | 0,06 | 0,08 | 0,10 | 0,15 |
Determina la concentración del herbicida en un alimento sabiendo que la absorbancia es igual a 0,047.
4. Se desea determinar el porcentaje de manganeso en un acero inoxidable comercial. Para eso se disolvió una muestra de acero de 0,4895 g y todo el manganeso se oxidó a estado de permanganato en medio sulfúrico (MnO4-). La solución se diluyó a 100,00 mL en un matraz aforado. La absorbancia a 525 nm en una celda de 1 cm fue 0,396. Se determinó la absorbancia de una solución patrón de permanganato de concentración 3.10-4 mol/L siendo de 0,672.
