Química - 3º C.B.
- General
General

Los siguientes Módulos de Aprendizaje fueron diseñados para ser utilizados por docentes y estudiantes de la asignatura Química de 3° año de C.B.
Son 32 módulos que recorren de manera secuenciada los diferentes contenidos previstos en el Programa Oficial del C.E.S. Cada módulo contiene una ficha teórica y variadas actividades graduadas según nivel de dificultad donde se propone la utilización de múltiples recursos.
Dentro de los 32 módulos hay 6 que incluyen temáticas transversales, los cuales están identificados con el número y nombre en color rojo.
El material ha sido diseñado por las profesoras del Proyecto AVEQ:
- Carina Banchero
- Lucía Notari
- Alison Pazos
- Erika Turubich
Mail de contacto: inspquimica@gmail.co
m - Carina Banchero
Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
Para saber cómo restaurar el archivo descargado en su aula personal lea la siguiente información.
Estabilidad química
- Estabilidad química
Estabilidad química

ESTABILIDAD QUÍMICA
Los átomos tienden a un estado de menor energía, lo que implica una mayor estabilidad química. Esta es la clave para entender porqué interactuán entre ellos estableciendo diferentes enlaces químicos (uniones químicas).La mayoría de los átomos sin unirse o enlazarse presentan situaciones de baja estabilidad química. Sin embargo, los gases inertes (grupo 18), se caracterizan por su alta estabilidad química, es decir, no reaccionan salvo raras excepciones. La gran estabilidad química de los gases inertes se asocia a que tienen 8 electrones en su último nivel, esto se conoce como regla del octeto (excepto los átomos de He).Los átomos tienden a ganar, perder o compartir electrones quedando con 8 electrones en su nivel más externo, adquiriendo de este modo una estructura electrónica como la que tiene el gas noble más cercano en la Tabla Periódica.
 Los metales presentan una tendencia a perder electrones, por ejemplo, los átomos de Sodio (grupo 1), tienen un electrón de valencia y tienden a perderlo quedando con la distribución electrónica del Neón. Mientras que los no metales tienden a ganar electrones. Los átomos de cloro (grupo 17), por ejemplo, tienden a ganar un electrón, adquiriendo la distribución electrónica del Argón.Diagrama de LewisEl diagrama de Lewis consiste en representar los electrones del último nivel de energía (electrones de valencia) con puntitos alrededor del símbolo del elemento.
Los metales presentan una tendencia a perder electrones, por ejemplo, los átomos de Sodio (grupo 1), tienen un electrón de valencia y tienden a perderlo quedando con la distribución electrónica del Neón. Mientras que los no metales tienden a ganar electrones. Los átomos de cloro (grupo 17), por ejemplo, tienden a ganar un electrón, adquiriendo la distribución electrónica del Argón.Diagrama de LewisEl diagrama de Lewis consiste en representar los electrones del último nivel de energía (electrones de valencia) con puntitos alrededor del símbolo del elemento. Veamos la estructura de Lewis para algunos elementos representativos …
Veamos la estructura de Lewis para algunos elementos representativos …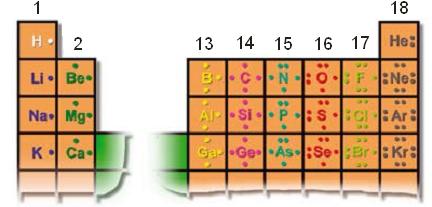 Observaciones:• Para los elementos representativos de los grupos 1 y 2 la cantidad de electrones de valencia coincide con el número de grupo, y para los demás con el segundo dígito del número de grupo, por ejemplo, grupo 13: 3 electrones de valencia. (excepto el He del grupo 18, que tiene 2 electrones de valencia).• En un grupo, las propiedades químicas de los elementos son similares, esto se debe a que tienen la misma cantidad de electrones de valencia.
Observaciones:• Para los elementos representativos de los grupos 1 y 2 la cantidad de electrones de valencia coincide con el número de grupo, y para los demás con el segundo dígito del número de grupo, por ejemplo, grupo 13: 3 electrones de valencia. (excepto el He del grupo 18, que tiene 2 electrones de valencia).• En un grupo, las propiedades químicas de los elementos son similares, esto se debe a que tienen la misma cantidad de electrones de valencia.
