Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 8: Soluciones
- Módulo 8: Soluciones
Módulo 8: Soluciones

Un rápido repaso...
En tercer año estudiaste el tema soluciones, y aprendiste que son mezclas homogéneas de dos o más componentes. Por lo general, uno de estos componentes se encuentra en mayor proporción y se denomina solvente. Al que está presente en menor proporción, le llamamos soluto.
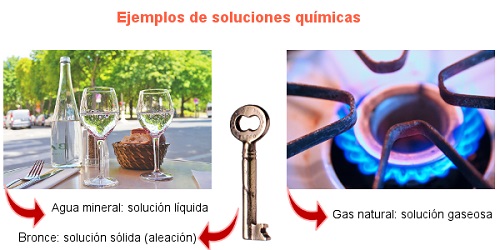
Cuando piensas en una solución química por lo general te imaginas soluciones líquidas, y eso está bien puesto que la mayoría pertenecen a esta clasificación (sal en agua, dióxido de carbono disuelto en el líquido de las bebidas gaseosas, alcohol disuelto en agua, etc). De hecho, el agua es considerado el solvente universal, por tanto, tu concepto acerca de las soluciones no es erróneo dado que la mayoría de las soluciones son acuosas.
¿Lo semejante se disuelve en lo semejante?
Por lo general sí. Podemos usar esta primera regla para entender en parte el proceso de disolución. Por ejemplo, los solventes polares como el agua y el alcohol, son muy buenos solventes para solutos iónicos (sales, óxidos).
Pero el agua no es un buen solvente para el caso de sustancias que no son polares, o presentan una mínima polaridad como es el caso del aceite, la parafina, la nafta.

Matraces aforados: se utilizan para preparar soluciones de concentración exacta
Clasificación
Solución no saturada: Es aquella que puede admitir más soluto hasta alcanzar su grado de saturación. Asimismo, las soluciones no saturadas pueden ser diluidas o concentradas. En las primeras, la cantidad de soluto es pequeña en relación al volumen de solución; en las concentradas, la cantidad de soluto es apreciable en relación al volumen de la solución.

Solución saturada: En este tipo de solución, existe un equilibrio entre el soluto y el medio dispersante, y el solvente no será capaz de disolver más soluto. En algunos casos es posible seguir agregando soluto, aumentando la temperatura lo que puede provocar una precipitación del sólido cuando la solución enfríe o en caso de que el solvente ya no tenga más capacidad de disolver el soluto.
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
