Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 11: Cantidad química
- Módulo 11: Cantidad química
Módulo 11: Cantidad química

¿Qué es la cantidad química?
Todas las muestras de sustancias tienen propiedades comunes que son medibles, y constituyen magnitudes físicas. Estas muestras de sustancias tienen la propiedad de ser atraídas por el campo gravitatorio de la tierra, y de ofrecer determinada resistencia a modificar su estado de reposo o movimiento. Esto se define como la magnitud física masa, cuyo símbolo es m y cuya unidad es el kilogramo en el Sistema Internacional de Unidades (SI).

Una magnitud que muchas veces usamos en Química es la cantidad química, cuyo símbolo es n y su unidad es el mol en el SI.
El mol se define de la siguiente forma: “el mol, símbolo mol, es la unidad SI de cantidad de sustancia de una entidad elemental, la cual puede ser un átomo, molécula, ion, electrón, o cualquier otra partícula o un grupo específico de tales partículas; su magnitud se establece mediante la fijación del valor numérico de la constante NA de Avogadro que es 6,02214076 × 1023 (*), cuando es expresado en la unidad SI mol-1 .” (*) valor establecido hasta el momento.
La expresión "entidades elementales" refiere a átomos, moléculas, iones, electrones u otras partículas con dimensiones del orden ultramicroscópico.
El número de átomos que hay en 12 g de carbono puro es 6,02 x 1023. Este número se conoce como Constante de Avogadro, en honor al científico italiano Amadeo Avogadro. Este número es muy grande pues corresponde a 602.000 trillones.
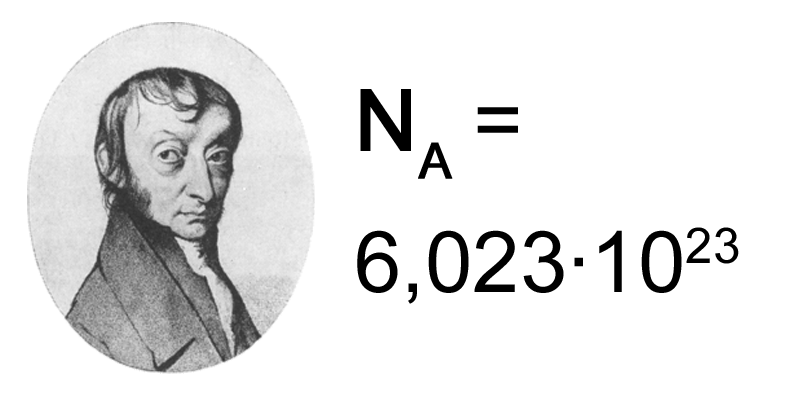
Relación cantidad química (n) y número de partículas (N)
La magnitud cantidad química es directamente proporcional al número de partículas presentes en una muestra. Ambas magnitudes se relacionan mediante la constante de Avogadro.
Expresión matemática: N = n x NA n = N / NA
Por ejemplo:
1. ¿Cuántas moléculas hay en 3,40 mol de agua?
Aplicando la expresión matemática: N = n x NA
N = 3,40 mol x 6,02.1023 = 2,0468 .1024
Redondeando 2,05.1024 moléculas de agua
2. ¿Qué cantidad química de cloruro de sodio hay en 2,45 .1023 partículas?
Aplicando la expresión matemática n = N / NA
n = 2,45 . 1023 / 6,02 . 1023 = 0,4069
Redondeando 0,407 mol.

Material extraído y adaptado de: Hill, J. y Kolb, D. (1999). Química para el nuevo milenio (8va edición). México: Pearson Prentice Hall.
Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012) Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
LATU. (s.f.). Redefinición de mol. Recuperado de: https://www.latu.org.uy/wp/wp-content/uploads/2018/05/Redefinici%C3%B3n-del-mol.pdf
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
