Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 13: Molaridad
- Módulo 13: Molaridad
Módulo 13: Molaridad

En módulos anteriores repasamos el concepto de solución y los tipos de soluciones. Aprendimos que dependiendo de su concentración, las soluciones se clasifican en diluidas, concentradas, y saturadas.
Repasando cómo expresar las concentraciones
La concentración de las soluciones dependerá de la cantidad de soluto contenida en una cantidad determinada de solvente o solución, dependiendo de la unidad seleccionada para expresarla.
Recuerda que los solutos no siempre son sólidos. Para comprender esto, te invitamos a leer el siguiente fragmento:
“Parte del dioxígeno que consumen los peces y otros organismos que viven en el agua, provienen del dioxígeno gaseoso que se disuelve directamente del aire que se encuentra sobre la superficie tranquila del agua. El dioxígeno gaseoso también se incorpora al agua natural a través de la fotosíntesis, el proceso por el cual las plantas verdes y el plancton del océano fabrican glúcidos a partir de dióxido de carbono y agua en presencia de luz solar. Los organismos que viven en un entorno acuático compiten de manera continua por el dioxígeno disponible. Las bacterias que consumen dioxígeno (bacterias aerobias) se alimentan de los desechos sólidos de animales más grandes y de sus restos cuando éstos mueren. La concentración mínima de dioxígeno disuelto necesaria para la vida acuática depende del tipo de animal que se considere. Los peces no pueden vivir en agua que tenga un nivel de dioxígeno disuelto inferior a 0,004 gramos por 1000 g de solución. Si se reduce la concentración de dioxígeno disuelto, las especies de peces que requieren más dioxígeno emigrarán a otras regiones del agua o bien morirán”.
Texto extraido y adaptado de: American Chemical Society. (1998) Quim Com. Química para la comunidad. (2da Edición) México: Addison Wesley.

La Molaridad, es otra forma de expresar la concentración de una solución:
M= n (mol) soluto / V (L) de solución
Siendo n: cantidad química y V: volumen

Ejemplo: Se tiene una solución de hidróxido de sodio (NaOH) preparada disolviendo 40 g de esta sustancia en 500 mL de solución. Calcular la molaridad de la solución.
En primer lugar, debemos determinar la cantidad química de NaOH, conociendo el valor de la masa molar de esta sustancia (40 g /mol).
n NaOH= masa (g) /
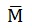 (g/mol)
(g/mol)n NaOH= 40g /40g/mol
n NaOH= 1,0 mol
Molaridad NaOH= 1.0 mol / 0,500 L
Molaridad NaOH= 2.0 mol/L

Hidróxido de sodio en perlas (sólido)

Solución de hidróxido de sodio envasada.
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
