Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 17: pH
- Módulo 17: pH
Módulo 17: pH

pH
En 1909 el químico danés S. P. L. Sörensen propuso el concepto de pH que permite comparar fácilmente la acidez o basicidad de una solución.
Si deseas puedes repasar qué es un ácido o una base revisa el módulo anterior.
El pH es un valor numérico (no tiene unidad), y se puede calcular utilizando la siguiente expresión matemática:
pH = - log [H+]
Siendo [H+]: la concentración del catión hidrógeno expresada en mol/L o M.
[H+] (mol/L)
pH 1x100 0 1x10-1 1 1x10-2 2 1x10-3 3 1x10-4 4 1x10-5 5 1x10-6 6 1x10-7 7 1x10-8 8 1x10-9 9 1x10-10 10 1x10-11 11 1x10-12 12 1x10-13 13 1x10-14 14 Escala de pH
Los valores de la escala de pH están comprendidos entre 0 y 14. Esta escala se aplica a soluciones acuosas de ácidos o bases que tienen una concentración menor o igual a 1,0 mol/L, y a una temperatura de 25,0 ºC.
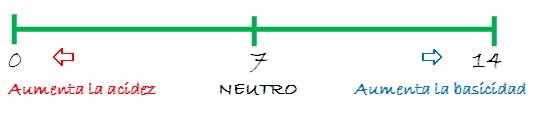
- Las soluciones que tienen valores de pH menores a 7 son soluciones ácidas.
- Si su valor de pH es igual a 7, es una solución neutra.
- Y si por el contrario, su valor de pH es mayor a 7 es una solución alcalina o básica.
Cuanto más cercano a 0 sea el valor del pH, más ácida será la solución, y cuanto más cercano a 14 más básica o alcalina será.
Reactivos indicadores:
Un poco de historia...
En 1664, Boyle escribió “The Experimental History of Colours”. En ella se inicia el reconocimiento de ácidos y bases a través de los cambios de color de extractos de plantas. A partir de Boyle, el cambio de color del jarabe de violetas, sirvió para indicar la presencia de un ácido; en este momento nacen los indicadores químicos. Sin embargo el primer reconocimiento, no lo fue con motivo de los cambios de color, ya que 8 años antes, Glauber había definido la “efervescencia del espíritu ácido” como señal inequívoca de su existencia. En 1671, Duclós llama “turnesol” (litmus), a un indicador extraído de líquenes, que le da un gran resultado. Casi cien años después, James Watt, el inventor de la máquina de vapor y nominador del caballo de vapor como unidad de potencia, descubre que la lombarda (col roja) es uno de los mejores indicadores.
Material extraído y adaptado de: http://www.heurema.com/QG7.htm
Los reactivos indicadores o también llamados indicadores ácido-base, son sustancias naturales o sintéticas que tienen colores distintos si se encuentran en una solución ácida o en una solución básica.
Ejemplos: fenolftaleína, azul de bromotimol, rojo de metilo, extracto de repollo rojo (col lombarda), extracto de remolacha, jugo de limón, solución de curry, extracto de pétalos de flores.

Medición del pH:
Si se desea conocer el valor exacto del pH, en vez de emplear un reactivo indicador, podemos medirlo utilizando uno de los siguientes métodos.
- Método colorimétrico: Se emplean tiras de papel indicador de pH (se logran impregnando varios reactivos indicadores en el papel), y se compara el color de la tira, luego de que fue humedecida con la solución a estudiar, con la escala de colores que se encuentra en el envase del papel indicador. Se puede determinar el valor del pH con diferencias de una unidad.


- Método electrométrico: Se utiliza un aparato llamado peachímetro que se sumerge en la solución a medir. Luego de realizar la medición se debe lavar la parte que se sumerge (llamado electrodo) con agua destilada, esperar que se seque para recién guardar el peachímetro. Debemos ser muy cuidadosos al manejarlo ya que es un aparato muy delicado.
La ventaja que presenta es que es más exacto que el papel indicador ya que podemos obtener una medida con centésimos (ejemplo pH = 4,96).

Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
