Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 7: Hidratación de iones
- Módulo 7: Hidratación de iones
Módulo 7: Hidratación de iones

Fuerzas interpartículas:
Comencemos repasando lo que ya has trabajado. En el módulo 4, -Puente de hidrógeno- estuvimos analizando que las fuerzas interpartículas son las interacciones entre las distintas partículas que forman a los materiales. Trabajamos con un ejemplo, el puente de hidrógeno, un tipo de atracción entre dipolos.
En este módulo profundizaremos sobre la interacción entre los dipolos (presentes en las moléculas de agua), y los iones presentes en compuestos iónicos, como por ejemplo la sal de mesa, cloruro de sodio (NaCl).
Proceso de hidratación:
¿Qué ocurre cuando disolvemos sal de mesa en agua?
La sal de mesa, cloruro de sodio, es un compuesto iónico formado por cationes sodio (Na+) y aniones cloruro (Cl-). Al entrar en contacto con el agua, formada por moléculas polares, se separan dichos iones e interactúan con las moléculas de agua que los rodean.
En el caso del catión sodio con carga positiva, se ve atraído por el polo negativo (átomo de oxígeno) de las moléculas de agua que lo rodean. El anión cloruro con carga negativa, se atrae con los átomos de hidrógeno, es decir, el polo positivo de la molécula de agua. Esta interacción es llamada ion-dipolo.
Si el agua es el solvente utilizado, decimos que los iones se encuentran hidratados.
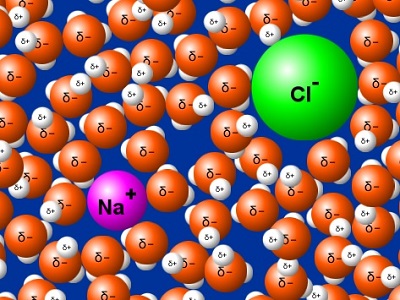
Imagen obtenida con el simulador PHET.
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
