¿Qué son los catalizadores y los mecanismos de reacción?
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química - 3º B.D. |
| Libro: | ¿Qué son los catalizadores y los mecanismos de reacción? |
| Imprimido por: | Invitado |
| Día: | lunes, 7 de abril de 2025, 12:45 |
1. Mecanismo de reacción
![]()
Un ecuación balanceada que representa una reacción química indica las sustancias presentes al comienzo de la reacción así como los que se producen a medida que va transcurriendo el cambio.
Sin embargo, no nos da información sobre cómo ocurre la reacción. El proceso por el que se lleva a cabo una reacción se denomina mecanismo de reacción. Es la secuencia de pasos elementales que conducen a la formación del producto. Los pasos elementales o reacciones elementales son una serie de reacciones sencillas que representan el avance de la reacción global a nivel de partículas.
Un mecanismo de reacción es, entonces, una sucesión de reacciones elementales que describen los cambios que se considera que tienen lugar a medida que los reactivos se transforman en productos. En un tipo de modelo especial propio de cada reacción que describe con gran detalle el orden de ruptura y formación de enlaces, y los cambios en las posiciones relativas de los átomos en el curso de la reacción.
Usando una combinación de datos experimentales y la intuición química, se puede postular un mecanismo por el cual puede tener lugar una reacción. Nunca se puede demostrar de forma absoluta que un mecanismo propuesto sea el correcto. Lo más que se puede hacer es postular un mecanismo consistente con los datos experimentales (ley de rapidez y otras especies observadas). Y si luego si se detectan especies intermedias que no forman parte del mecanismo propuesto, se lo modifica o propone un mecanismo nuevo.
1.1. Pasos elementales
![]()
Ya hemos visto que las reacciones ocurren como resultado de partículas reaccionantes.
Al parecer la reacción entre el monóxido de nitrógeno (NO) y el ozono (O3) para formar dióxido de nitrógeno (NO2) y dioxígeno (O2) ocurre como resultado de una sola colisión entre las moléculas de NO y O3 con la orientación correcta y la energía necesaria.
NO (g) + O3 (g) → NO2 (g) + O2 (g)
Este proceso en un solo paso o etapa que se conoce como proceso elemental o paso elemental.
Observa el siguiente video que representa el proceso ocurrido. Recuerda activar los subtítulos y traducirlos al español, puedes ver cómo hacerlo en el siguiente enlace.
This is a modal window.
![]()
El número de moléculas (átomos o iones) que participan como reactivos en un paso elemental específico define la molecularidad del paso.
- Si interviene una sola molécula, la reacción es unimolecular.
- Los pasos elementales en los que chocan dos moléculas reaccionantes son bimoleculares.
- Los pasos elementales en los que se produce la colisión simultánea de tres moléculas son termoleculares (o trimolecular). Los pasos termoleculares son muchísimo menos probables que los procesos unimoleculares o bimoleculares, y rara vez se presentan.
La probabilidad de que cuatro o más moléculas choquen simultáneamente con alguna regularidad es aún más remota; en consecuencia, nunca se propone este tipo de colisiones como parte de un mecanismo de
reacción.
![]()
El cambio neto representado por una ecuación química balanceada suele ocurrir por un mecanismo de pasos múltiples, que consiste en una serie de pasos elementales. Una reacción no elemental se da en varios pasos, por ejemplo la formación de dióxido de nitrógeno (NO2) a partir de dioxígeno (O2) y monóxido de nitrógeno (NO):
O2 (g) + 2 NO(g) → 2 NO2 (g)
Se sabe que los productos no se forman directamente como resultado de la colisión de dos moléculas de NO con una molécula de O2, porque se ha detectado la presencia de N2O2 (dióxido de dinitrógeno) durante el curso de la reacción. La reacción se podría llevar a cabo de la siguiente manera: en la primera etapa elemental, dos moléculas de NO chocan para formar una molécula de N2O2; después sigue la reacción entre N2O2 y O2 para formar dos moléculas de NO2.
Paso 1: NO + NO → N2O2
Paso 2: O2 + N2O2 → 2 NO2
____________________________________________________________________________
Reacción global: N2O2 + O2 + 2 NO → 2 NO2 + N2O2
1.2. Ejemplo 1 - Descomposición del peróxido de hidrógeno
![]()
Quizás en algún momento hayas presenciado un experimento denominado pasta de dientes de elefante.


A continuación podrás repasar en el video qué es lo que ocurre.
* Los residuos no son corrosivos ni peligrosos. Pueden manchar la piel de amarillo debido al diyodo (I2). Parte de los iones yoduro (I-) se oxidan a diyodo que reacciona con los iones yoduro para formar el ion triyoduro (I3-), que es de color café. No se recomienda tocar dichos residuos ya que quedan a alta temperatura.
![]()
El peróxido de hidrógeno (H2O2) comúnmente conocido como agua oxigenada, es relativamente estable a temperatura ambiente, pero su descomposición puede acelerarse con diferentes sustancias que denominamos catalizadores. La luz del día y la temperatura favorecen su descomposición, por lo que debe conservarse en la heladera.
En este experimento la sustancia que acelera la descomposición del peróxido
de hidrógeno es el yoduro de potasio (KI).
En la descomposición se libera dioxígeno gaseoso (O2), que burbujea dentro del
detergente y se forma espuma.
La reacción global se puede representar con la siguiente ecuación química:
2 H2O2 (ac) → 2 H2O (l) + O2 (g)
![]()
Experimentalmente se encontró que la ley de rapidez es:
r = k . [H2O2] . [I-]
La reacción es de orden 1 tanto respecto al peróxido de hidrógeno como al anión yoduro (I-), y de orden global o total 2.
Esta descomposición no ocurre en un solo paso elemental que corresponde a la ecuación global, ya que si así fuera la reacción sería de segundo orden con respecto al peróxido como resultado de las colisión de dos moléculas de H2O2. Además el anión yoduro no aparece en la ecuación global, pero sí aparece en la ley de rapidez.
![]()
Se puede explicar la ley de rapidez observada suponiendo que la reacción se lleva a cabo en dos pasos elementales independientes, siendo cada uno de ellos bimoleculares (recuerda que el yoduro no es una molécula, sino un anión).
Paso 1: H2O2 + I- → H2O + IO-
Paso 2: H2O2 + IO- → H2O + O2 + I-
__________________________________________________________
Reacción global: H2O2 + I- + H2O2 + IO- → H2O + IO- + H2O + O2 + I-
Si, además, se supone que el paso 1 es el paso determinante, entonces la rapidez de la reacción se determina a partir del primer paso.
Observa el siguiente video:
![]()
El anión IO- (denominado hipoyodito) es un intermediario ya que no aparece en la ecuación global. A pesar de que el anión yoduro tampoco aparece en la ecuación global, difiere del anión hipoyodito, en que el primero se encuentra presente tanto al inicio de la reacción como al finalizar la misma. La función del anión yoduro (I-) es la de aumentar la rapidez de la reacción, es decir es un catalizador.
1.3. Paso determinante de la rapidez de una reacción
![]()
El paso elemental más lento en una secuencia de reacciones que gobierna la rapidez de formación de productos global se denomina paso determinante de la rapidez de la reacción.
Las reacciones elementales que siguen al paso determinante de la rapidez no contribuyen a la ley de rapidez obtenida a partir del mecanismo.
1.4. Ejemplo 2 - Formación de yoduro de hidrógeno
![]()
Un mecanismo de reacción común es aquel que incluye, por lo menos, dos pasos elementales, el primero de los cuales es muy rápido comparado con el segundo paso.
Un ejemplo lo constituye la reacción entre el dihidrógeno (H2) y el diyodo (I2) para producir yoduro de hidrógeno (HI).
H2 (g) + I2 (g) → 2 HI (g)
Experimentalmente se encontró que la ley de rapidez es:
r = k. [H2] . [I2]
![]()
Durante muchos años se pensó que la reacción era una reacción bimolecular que requería una molécula de dihidrógeno y una molécula de diyodo. Sin embargo, en la década del sesenta se encontró que el mecanismo real es más complejo. Se propuso un mecanismo en tres pasos:
Paso 1: I2 → 2 I (rápido)
Paso 2: H2 + I → H2I (rápido)
Paso 3: H2I + I → 2 HI (lento)
__________________________________________________________
Reacción global: I2 + H2 + I + H2I + I → 2 I + H2I + 2 HI
![]()
Los átomos de yodo (I) son los intermediarios en esta reacción. Cuando inicia la reacción, hay muy pocos átomos de I presentes. Pero, a medida que el diyodo (I2) se disocia, disminuye su concentración mientras que la de I aumenta.
El paso 3 es el más lento, por lo que se le denomina el paso determinante.
Este mecanismo proporciona la ley de rapidez correcta para la reacción. Esta concordancia, además de la presencia de los átomos de yodo como intermediarios, constituye una fuerte evidencia para avalar este mecanismo como correcto.
![]()
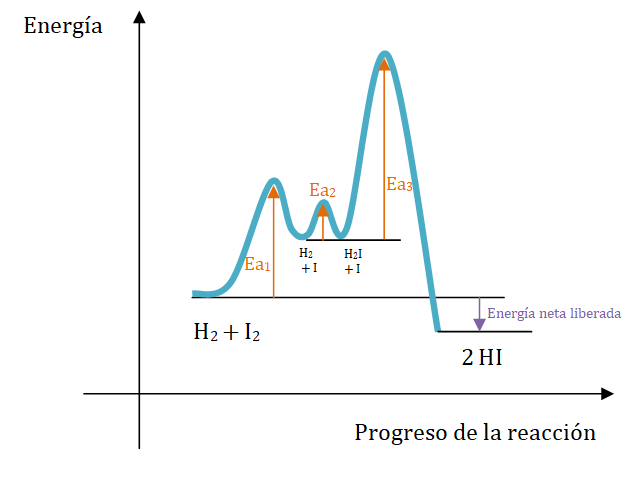
En este caso ninguno de los reactivos originales aparecen en el paso determinante de rapidez, pero ambos aparecen en la expresión de la ley de rapidez. Cada paso es una reacción en sí misma y posee su energía de activación propia. Debido a que el paso 3 es el más lento, se sabe que su energía de activación es la más alta.
En la siguiente representación gráfica se observan las energías de activación relativas para el mecanismo postulado en la reacción en fase gaseosa:
1.5. Mecanismo de reacción y la expresión de la ley de rapidez
![]()
Algunas reacciones tienen lugar en una sola etapa, pero la mayoría de las reacciones ocurren en una serie de etapas elementales.
![]()
Los órdenes parciales de reacción para una reacción que ocurre en un solo paso coinciden con los coeficientes para esa etapa.
Por ejemplo: La reacción entre el monóxido de nitrógeno (NO) y el ozono (O3) para formar dióxido de nitrógeno (NO2) y dioxígeno (O2) ocurre como resultado de una sola colisión entre las moléculas de NO y O3 con la orientación correcta y la energía necesaria.
NO (g) + O3 (g) → NO2 (g) + O2 (g)
La ley de rapidez sería: r = k . [NO] . [O3]Los órdenes parciales, en este caso x = 1 e y = 1, coinciden con los coeficientes estequiométricos.
![]()
En muchos mecanismos, sin embargo, una etapa es mucho más lenta que las demás. Una reacción nunca puede tener lugar más rápidamente que su etapa más lenta. Esta etapa más lenta se denomina etapa o paso determinante de una reacción. La rapidez a la cual ocurre la etapa lenta limita la rapidez a la cual tiene lugar la reacción global.
La ecuación ajustada para la reacción global es igual a la suma de todas las etapas individuales, incluyendo cualquier etapa que pueda seguir a la etapa determinante de la reacción. Los exponentes de la expresión de la ley de rapidez no necesariamente coinciden con los coeficientes de la ecuación global ajustada.
Los órdenes parciales de reacción determinados experimentalmente indican el número de partículas (moléculas, átomos, iones) de aquellos reactivos implicados en 1) la etapa lenta solamente, si ocurre primero, o 2) la etapa lenta y cualesquiera otras etapas rápidas que preceden al paso lento.
Por ejemplo: La reacción entre el dióxido de nitrógeno (NO2) y el monóxido de carbono (CO) que produce monóxido de nitrógeno (NO) y dióxido de carbono (CO2) es de segundo orden respecto a NO2 y de orden cero respecto a CO:
NO2 (g) + CO (g) → NO (g) + CO2 (g)
Ley de rapidez: r = k . [NO2]2
A continuación podemos analizar el mecanismo propuesto para esta reacción:
Paso 1: NO2 (g) + NO2 (g) → NO3 (g) + NO (g) (lento)
Paso 2: NO3 (g) + CO (g) → NO2 (g) + CO2 (g) (rápido)
__________________________________________________________
Reacción global: NO2 (g) + CO (g) + NO3 (g) → NO (g) + CO2 (g) + NO3 (g)
El paso 2 es mucho más rápido que el paso 1. El intermediario NO3 se produce lentamente en el paso 1 y se transforma de inmediato en el paso 2.
Dado que el paso 1 es lento y el paso 2 es rápido, el paso 1 es determinante de la rapidez. Por tanto, la rapidez de la reacción global es igual a la rapidez del paso 1. Este paso es un proceso bimolecular.
Así pues, la ecuación de rapidez que este mecanismo predice concuerda con lo que se observa experimentalmente.
2. Catálisis
![]()
La rapidez de muchas reacciones crece si aumenta la concentración de los reactivos o la temperatura. De manera similar, si la reacción es heterogénea se puede aumentar la rapidez mediante el aumento de la superficie de un reactivo. Si se desea aumentar la rapidez para determinada concentración o superficie sin elevar la temperatura se puede emplear un catalizador.
Un catalizador es una sustancia que aumenta la rapidez de una reacción sin ser "consumida" en la misma. El nombre proviene de las palabras griegas que significan "destrucción al reunirse". En muchos casos, solo se necesita una pequeña cantidad de catalizador, dado que actúa una y otra vez.
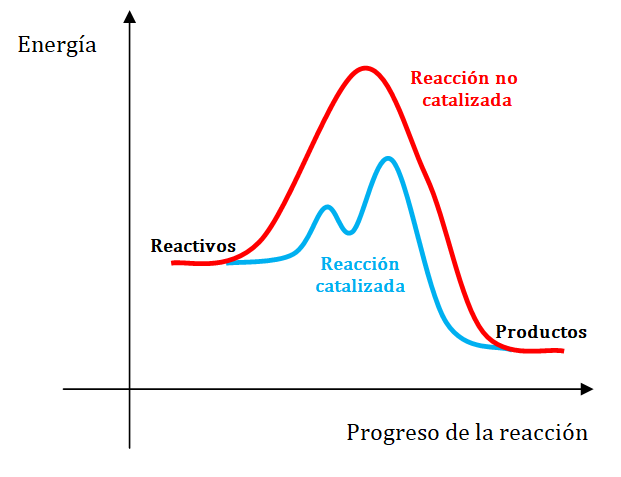
El catalizador acelera una reacción proporcionando un camino alternativo. o sea un mecanismo de reacción diferente, entre los reactivos y los productos. Este nuevo camino presenta una energía de activación más baja que la del camino original como se puede observar en la siguiente representación gráfica.
Observa el siguiente video:
![]()
Los múltiples catalizadores conocidos en la actualidad pueden ser clasificados según
varios criterios: estructura, composición, área de aplicación o estado de agregación. La
clasificación más habitual es la referente a los estados de agregación en que actúan los
catalizadores. Hay dos grandes grupos: catalizadores heterogéneos y homogéneos.
También existen formas intermedias tales como los catalizadores homogéneos ligados a
sólidos, dentro de los cuales se incluyen el grupo de los biocatalizadores. La forma de catálisis más importante es con mucho la heterogénea; de hecho, el mercado de los
catalizadores homogéneos supone sólo entre un 10 y un 15 % del total.
Se puede hablar de tres tipos de catálisis:
- catálisis homogénea
- catálisis heterogénea
- catálisis enzimática (puedes repasar las características de este tipo de catálisis en el siguiente enlace)
A continuación se analizarán los dos primeros.
2.1. Catálisis homogénea
![]()
Un catalizador homogéneo es aquel que se encuentra en la misma fase que los reactivos. Para los reactivos que son gases, un reactivo homogéneo es también un gas. Si los reactivos son líquidos. un catalizador homogéneo se disuelve en la solución.
![]()
El dibromo disuelto es un catalizador homogéneo de fase líquida para la descomposición del peróxido de hidrógeno. En ausencia de dibromo u otro catalizador, el peróxido de hidrógeno puede almacenarse durante un tiempo prolongado a temperatura ambiente; sin embargo, en cuanto se agrega una gota de dibromo se forman burbujas de dioxígeno.
Paso 1: Br2 (ac) + H2O2 (ac) → 2 Br- (ac) + H+ (ac) + O2 (g)
Paso 2: 2 Br- (ac) + H2O2 (ac) + 2 H+ (ac) → Br2 (ac) + 2 H2O (l)
__________________________________________________________
Reacción global: Br2 + H2O2 + 2 Br- + H2O2 + 2 H+ → 2 Br- + H+ + O2 + Br2 + 2 H2O
![]()
El catalizador es el dibromo (Br2) y el bromuro (Br-) actúa como intermediario. De ese modo, a pesar de que las moléculas de dibromo hayan participado en la reacción. no se "consumen" y pueden participar de la reacción una y otra vez.
![]()
La catálisis homogénea también puede llevarse a cabo en fase gaseosa. Un ejemplo conocido de reacciones catalizadas en fase gaseosa es el proceso en una cámara de plomo que durante muchos años fue el método más importante para la manufactura de ácido sulfúrico. Utilizando azufre como materia prima, se esperaría que la producción de ácido sulfúrico ocurriera según los siguientes pasos:
S (s) + O2 (g) → SO2 (g)
2 SO2 (g) + O2 (g) → 2 SO3 (g)
H2O (l) + SO3 (g) → H2SO4 (ac)
Sin embargo, en realidad, el dióxido de azufre (SO2) no se convierte directamente en trióxido de azufre (SO3); la oxidación resulta más eficiente cuando se lleva a cabo en presencia del catalizador dióxido de nitrógeno (NO2):
Paso 1: 2 SO2 (g) + 2 NO2 (g) → 2 SO3 (g) + 2 NO (g)
Paso 2: 2 NO (g) + O2 (g) → 2 NO2 (g)
__________________________________________________________
Reacción global: 2 SO2 (g) + 2 NO2 (g) + 2 NO (g) + O2 (g) → 2 SO3 (g) + 2 NO (g) + 2 NO2 (g)
![]()
Observa que no existe pérdida neta de NO2 en la reacción global, por lo que el NO2 cumple con los requisitos de un catalizador. El monóxido de nitrógeno (NO) actúa como intermediario.
2.2. Catálisis heterogénea
![]()
Un catalizador heterogéneo es aquel que se encuentra presente en una fase diferente de la de los reactivos. Los catalizadores heterogéneos más comunes son los sólidos finamente divididos o porosos utilizados en reacciones de fase gaseosa o de fase líquida. Se encuentran finamente divididos o son porosos para así proporcionar un área de superficie grande para las reacciones elementales que facilitan el camino catalítico.
El reactivo se adsorbe sobre la superficie del catalizador. Cuando una molécula del reactivo se une a la superficie del catalizador, sus enlaces se debilitan y la reacción puede avanzar con mayor rapidez porque los enlaces se rompen con más facilidad.
![]()
Un ejemplo es el catalizador hierro utilizado en el proceso Haber para la obtención de amoníaco. La formación de amoníaco (NH3) a partir de dinitrógeno (N2) y de dihidrógeno (H2) es un proceso exotérmico y se puede representar con la siguiente ecuación:
N2 (g) + 3 H2 (g) ⇄ 2 NH3 (g) ΔH° = - 92.6 kJ
Pero la rapidez de la reacción es extremadamente lenta a temperatura ambiente. Para que una reacción sea una operación práctica a gran escala, debe proceder a una rapidez apreciable y debe dar un alto rendimiento del producto deseado. Al aumentar la temperatura se acelera la reacción, pero al mismo tiempo se promueve la descomposición de moléculas de amoníaco en dinitrógeno y dihidrógeno, lo que reduce el rendimiento.
En 1905, después de probar literalmente con cientos de compuestos a varias temperaturas y presiones, Fritz Haber descubrió que el hierro, más un pequeño porcentaje de óxidos de potasio y de aluminio, cataliza la reacción de producción del amoníaco, aproximadamente a 500 °C. Este proceso se conoce como el proceso Haber.
En la catálisis heterogénea la superficie del catalizador sólido es, por lo general, el sitio donde se lleva a cabo la reacción. El paso inicial en el proceso Haber implica la disociación del dinitrógeno y del dihidrógeno en la superficie del metal. Aunque las especies disociadas no son en realidad átomos libres porque están unidas a la superficie del metal, son muy reactivas.
This is a modal window.
Las dos moléculas de reactivos se comportan de manera muy diferente en la superficie del catalizador. Los estudios han demostrado que el dihidrógeno se disocia en hidrógeno atómico a temperaturas tan bajas como - 196 °C. Por otra parte las moléculas de dinitrógeno se disocian aproximadamente a 500 °C. Los átomos de nitrógeno y de hidrógeno, que son muy reactivos, se combinan rápidamente a altas temperaturas, para producir las moléculas de amoníaco.
This is a modal window.
![]()
Un segundo ejemplo de un catalizador heterogéneo es el pentóxido de divanadio finamente dividido que se utiliza en el proceso de contacto para la producción de ácido sulfúrico.
| V2O5 | ||||
|---|---|---|---|---|
| 2 SO2 (g) | + | O2 (g) | → | 2 SO3 (g) |
Observa el siguiente video en el que se puede observar el proceso de producción del ácido sulfúrico.
Nota: recuerda que no es correcto decir grados centígrados, sino más bien grados Celsius (°C).
![]()
La descomposición de una solución de peróxido de hidrógeno al 30 % se puede catalizar por cantidades muy pequeñas de óxidos de metales de transición, como por ejemplo dióxido de manganeso (MnO2), como se puede observar en el siguiente video.
2.3. En resumen
Revisa los conceptos abordados en este módulo sobre los catalizadores que se destacan en el siguiente video:
3. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Portal Uruguay Educa - Octubre 2021.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias bibliográficas:
- Atkins. P. y Jones, L. (2005). Principios de Química. (3era edición). Editorial Panamericana.
- Brown, T., Le May, E., Bursten, B. y Burdge, J. (2004). Química. La Ciencia Central. (9na edición). México: Pearson Educación.
- Chang, R. (2007). Química. (9na edición). Mc Graw Hill.
- Huidobro, A. (2003). Introducción. TELAS DE CARBÓN COMO SOPORTE DE CATALIZADORES BIMETÁLICOS Pt-Sn. EFECTO PROMOTOR DEL TiO2. [Tesis Doctoral, Universidad de Alicante]. https://rua.ua.es/dspace/bitstream/10045/9907/6/Huidobro-Pahissa-Ana_2.pdf
- Mahan, B. y Myers, R. (1990). Química Curso Universitario. (4ta edición). Estados Unidos: Addison Wesley Iberoamericana.
- Químicad+. (2010). Guía del presentador. Facultad de Química de Uruguay. http://www.qdm.fq.edu.uy/imagenes/guia_presentadores.pdf
- Whitten, K., Davis, R. y Peck, M. (1998). Química General. (5ta edición). Madrid, España: Mc Graw Hill.
Videos y sitios:
- Chemistry Channel. (26 de abril de 2018). Oxidation of nitrogen monoxide by ozone [Archivo de Video]. Youtube. https://youtu.be/2IzREeP6i3Q
- Dinkits. (22 de junio de 2012). DINKITS: Pasta de dientes ¡para elefantes! Experimentos fáciles. [Archivo de Video]. Youtube. https://youtu.be/tHpsjF2qyQc
- Aaron Huggard. (11 de octubre de 2012). Potassium Iodide + Hydrogen Peroxide [Archivo de Video]. Youtube. https://youtu.be/awJ2KQzaxZA
- Universitat Rovira i Virgili. (6 de octubre de 2017). Ciencia en 1': ¿Qué hace un catalizador? [Archivo de Video]. Youtube. https://youtu.be/YQtUKMkUHKg
- Proyecto G. (18 de mayo de 2012). Catalizadores - Proyecto G [Archivo de Video]. Youtube. https://youtu.be/M6Gve8AZgvA
- Gfycat. (26 de abril de 2018). Industrial implementation of the ammonia synthesis -- How does it work? GIF [Gif]. Gfycat. https://thumbs.gfycat.com/CourageousAmpleBlackbird-mobile.mp4 / https://thumbs.gfycat.com/NegativeLateBichonfrise-mobile.mp4
- fq-experimentos. (3 de agosto de 2008). Descomposición del agua oxigenada [Archivo de Video]. Youtube. https://youtu.be/QCU144CrnSM
- Designmate Pvt. Ltd. - Official. (11 de septiembre de 2017). Producción de oxígeno a partir de peróxido de hidrógeno [Archivo de Video]. Youtube. https://youtu.be/9Bdk0gKyGBg
Imágenes:
- Ícono proceso. Autor: Becris. Licencia: Gratis para uso personal y comercial con atribución.
- Ícono pasta de dientes. Autor: Freepik. Licencia: Gratis para uso personal y comercial con atribución.
- Ícono elefante. Autor: Freepik. Licencia: Gratis para uso personal y comercial con atribución.