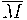Algunos conceptos teóricos
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Aula de apoyo para estudiantes 1º BG - 2018 - Pando |
| Libro: | Algunos conceptos teóricos |
| Imprimido por: | Invitado |
| Día: | miércoles, 3 de julio de 2024, 07:28 |
1. Estados de agregación de la materia
Visita el siguiente sitio
Elige la opción ESTADOS y sigue el orden de las viñetas superiores, y contesta las preguntas a continuación:
1. Estados: ¿Cuáles son las principales formas de agregación de la materia y qué características tiene cada una?
2. Estado sólido: ¿Qué movimiento tienen las partículas en la fase sólida?
¿Qué ocurre en la animación cuando aumenta la temperatura? ¿Cómo lo explicas?
3. Estado líquido: ¿Cómo se encuentran las partículas en la fase líquida? ¿Qué propiedades tienen los líquidos?
¿Qué ocurre en la animación cuando aumenta la temperatura? ¿Cómo lo explicas?
4. Estado gaseoso: ¿Cómo se encuentran las partículas en la fase gaseosa? ¿Qué propiedades tienen los gases?
¿Qué ocurre en la animación cuando aumenta la temperatura? ¿Cómo lo explicas?
5. Cambios de estado: ¿Qué es un cambio de estado? ¿Qué lo puede producir? ¿Qué cambios se citan?
¿Qué ocurre en la animación cuando se enciende el mechero? ¿Cómo lo explicas?
¿Qué ocurre con las partículas cuando el sistema alcanza el punto de fusión? Y ¿cuando alcanza el punto de ebullición?
6. Actividades finales: Luego de verificar que las respuestas están correctas completa el recuadro:
|
SÓLIDOS |
LÍQUIDOS |
GASES |
|
|
|
|
El siguiente vídeo te resume lo analizado:
2. Sólidos
- iNTRODUCCIÓN
En la naturaleza existen sustancias como el cloruro de sodio (NaCl), el azufre y el azúcar que son sólidos en las condiciones ambientales y por lo tanto poseen las propiedades de compresibilidad y rigidez, además los encontramos en la naturaleza con formas geométricas características. Estas sustancias con formas características los denominamos sólidos cristalinos y los distinguimos de los no cristalinos que los denominamos amorfos.
Las propiedades de los cristales reflejan su gran ordenamiento interno. Existen en la naturaleza muchos minerales cristalinos que muestran sus caras y ángulos bien definidos como el cuarzo natural (figura a la derecha). Otras veces muchas sustancias sólidas se presentan en polvo y se puede pensar que son amorfas, pero si se examina la partícula individual bajo el microscopio, los ángulos cristalinos se pueden visualizar. Por ello debemos distinguir entre sólidos policristalinos (metales, en general) y amorfos.
El tamaño de los cristales de una sustancia puede variar dependiendo de las condiciones en que se forma el cristal.
Para distinguir claramente sólidos cristalinos de amorfos es fundamental determinarles su punto de fusión, ya que los cristalinos tienen puntos de fusión bien definidos y los amorfos no tienen puntos de fusión definidos.
Luego de leer contesta:
1. ¿Qué tipos de sólidos existen?
2. ¿Se puede saber qué tipo de sólido es a simple vista?
- REDES CRISTALINAS:

|
TIPO DE CRISTAL |
Partículas de la celda unidad |
Fuerzas que mantienen unidas a las unidades |
Propiedades |
Ejemplos |
|
MOLECULARES |
moléculas o átomos |
dispersión, dipolo-dipolo y/o enlace de hidrógeno |
blandos, bajos PF (punto de fusión), malos conductores de la electricidad y el calor |
Ar, CO2, I2, H2O, C12H22O11 (sacarosa), CH4, O2, P4, NH3, SO2 |
|
IÓNICOS |
aniones y cationes |
electrostática |
duros, quebradizos, PF altos, malos conductores de la electricidad y el calor |
NaCl, LiF, MgO, CaCO3, KBr, (sales típicas) |
|
COVALENTES |
átomos |
enlace covalente |
muy duros, PF altos, malos conductores de la electricidad y el calor |
C (diamante), SiO2 (cuarzo), SiC |
|
METÁLICOS |
iones metálicos en nube electrónica |
enlace metálico |
suaves a duros, PF bajos a altos, buenos conductores de la electricidad y el calor |
Ag, Cu, Na, Fe, Mg, Cr, Ni, Li, K |
3. Líquidos
- INTRODUCCIÓN
En la fase líquida las fuerzas de atracción entre las partículas son lo suficientemente grandes para que se produzcan clusters o grupos variables y desordenados de partículas. Las partículas están tan próximas entre sí que muy poco del volumen ocupado por el líquido es espacio vacío. Como resultado es muy difícil comprimir un líquido. Las partículas son capaces de deslizarse entre sí de manera que los líquidos adoptan las formas de sus recipientes hasta el volumen total del líquido.
Los líquidos se difunden en otros líquidos con los cuales son miscibles. Por ejemplo, cuando una gota de colorante rojo para comidas se añade a un vaso de agua, toda el agua se pone roja después que se completa la difusión. Debido a que las separaciones entre las partículas de los líquidos son mucho menores que en gases, las densidades de los líquidos son mucho mayores que las densidades de los gases.
Al disminuir la temperatura de un líquido sus partículas disminuyen su movimiento, por lo que las fuerzas interpartículas más fuertes pero de menor alcance superan las energías cinéticas reducidas causando la solidificación.
Lee el texto y contesta:
1. ¿Cómo se ordenan las partículas de un líquido?
2. ¿Cómo explicas que:
- los líquidos sean difíciles de
comprimir?
- los líquidos adopten la forma
del recipiente que los contienen?
- los líquidos difunden en otros
líquidos miscibles?
- Los líquidos sean más densos
que los gases?
3. ¿Cuándo ocurre la solidificación?
Viscosidad:Es una medida de la resistencia de los líquidos a fluir. Cuánto más viscoso es un líquido, más lento es su flujo. La viscosidad de un líquido suele disminuir con el aumento de la temperatura.
Los líquidos con fuerzas interpartículas fuertes son más viscosos. También depende de la forma de las partículas.

Tensión superficial:
Es la cantidad de energía necesaria para estirar o aumentar la superficie de un líquido por unidad de área.
Las gotas de los líquidos tienden a adoptar formas esféricas para tener la menor área superficial posible.
Los líquidos con fuerzas interpartículas fuertes también tienen tensiones superficiales altas. Las partículas que se encuentran en la superficie son jaladas hacia abajo y a los lados por otras partículas pero no hacia arriba de la superficie. Esto ocasiona que la superficie se tense como si fuera una película elástica.

4. Gas: Variables de estado
- Temperatura (T): magnitud que se mide con un termómetro. Unidades: Celsius o Kelvin.

Conversión diferentes escalas termométricas: para practicar
- Presión (P): fuerza por unidad de superficie. Unidades: mm de Hg, hPa, atm, bar.
- Volumen (V): una magnitud que nos permite conocer cuánto "lugar" ocupa en el espacio. Unidades: mL (cm3) o L.
- Cantidad química (n): magnitud que relaciona la masa de una sustancia con la masa molar de la misma. Unidad: mol
m: masa expresada en gramos (g)
![]() : masa molar expresada en gramos por mol (g/mol)
: masa molar expresada en gramos por mol (g/mol)
Simulador (repasa las partes 1 2 y 3)
Una magnitud que muchas veces usamos en Química es la cantidad química, cuyo símbolo es n y su unidad es el mol en el SI.
El mol, se define como "la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos de carbono hay en 0,012 kg de carbono-12" (IUPAC 1967, BOE de 3-11-1989).
La expresión "entidades elementales" refiere a átomos, moléculas, iones, electrones u otras partículas con dimensiones del orden ultramicroscópico.
El número de átomos que hay en 12 g de carbono puro es 6,02 x 1023. Este número se conoce como Constante de Avogadro, en honor al científico italiano Amadeo Avogadro. Este número es muy grande pues corresponde a 602.000 trillones.
La magnitud cantidad química es directamente proporcional al número de partículas presentes en una muestra. Ambas magnitudes se relacionan mediante la constante de Avogadro.
Expresión matemática: N = n x NA n = N / NA
Por ejemplo:
1. ¿Cuántas moléculas hay en 3,40 mol de agua?
Aplicando la expresión matemática: N = n x NA
N = 3,40 mol x 6,02.1023 = 2,0468 .1024
Redondeando 2,05.1024 moléculas de agua
2. ¿Qué cantidad química de cloruro de sodio hay en 2,45 .1023 partículas?
Aplicando la expresión matemática n = N / NA
n = 2,45 . 1023 / 6,02 . 1023 = 0,4069
Redondeando 0,407 mol.
La cantidad química (n) y la masa (m) de una sustancia, se relacionan a través de la masa molar.
Es importante tener en cuenta que por definición, la Masa Molar de un elemento es la masa de un mol del mismo expresada en gramos y la unidad es g/mol.
Para poder saber la Masa Molar de un compuesto, debemos sumar las masas molares de todos los elementos que lo conforman.
Por ejemplo:

La magnitud cantidad química es directamente proporcional a la masa molar.
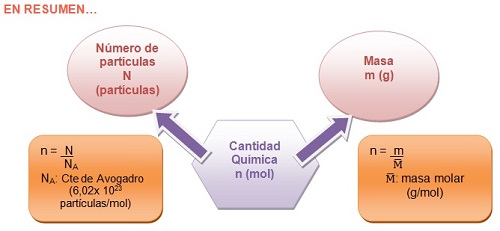
En resumen:
4.2. Leyes de los gases
- ACTIVIDAD 1: ISOTERMA
(no varía la temperatura)
Realiza la experiencia del programa Leyes de los Gases, Laboratorio, Sala Boyle, donde, partiendo de una cierta cantidad de gas a temperatura constante, vas cambiando el volumen del gas y mides la presión del sistema. Realiza 5 mediciones y luego apreta la sección gráfica. Observa las dos gráficas posibles.
INTERPRETANDO…
La presión de un gas es el efecto que producen los choques de las partículas por unidad de superficie en las paredes del recipiente. Si se reduce el volumen, se producirá mayor cantidad de choques de las partículas contra las paredes, el techo y el fondo del recipiente, por lo que la presión aumentará.
- ACTIVIDAD 2: ISÓBARA (no varía la presión)
Realiza la experiencia del programa Leyes de los Gases, Laboratorio, Sala Charles, donde, partiendo de una cierta cantidad de gas a presión constante, vas aumentando la temperatura del sistema y mides 5 volúmenes ocupados por el gas para cada aumento de temperatura. Intenta que uno de los valores sea el correspondiente a la temperatura más baja posible. Observa la gráfica.
INTERPRETANDO…
Cuando aumenta la temperatura del gas, aumenta la energía cinética de sus partículas. Éstas se separan más y, en consecuencia, aumenta el volumen.
- ACTIVIDAD 3: ISOCÓRICA (no varía el volumen)
Ley de Charles-Gay Lussac (1805):
Inspirado en las observaciones de Charles, Jospeh Gay Lussac enunció la ley según la cual en todo proceso isocórico (a volumen constante) la presión ejercida por la masa de un gas aumenta de manera proporcional con el aumento de la temperatura absoluta (en K). Para cada volumen de trabajo habrá una isocórica específica.
INTERPRETANDO…
A medida que aumentamos la temperatura aumentará la energía cinética, es decir se producirá mayor cantidad de choques de las partículas contra las paredes, el techo y el fondo del recipiente, por lo que la presión aumentará.
ACTIVIDAD 4: Ley de Avogadro
GAS
Volumen de 1 mol a PTN (L)
H2
22,425
N2
22,402
O2
22,394
CO2
22,264
NH3
22,084
4.3. Ecuación general de los gases
Observa el siguiente vídeo:
Ecuación general de los gases ideales:
P.V = n.R.T
Según las unidades de la presión será el valor de la constante universal de los gases: R

5. Créditos
Autoría de los materiales utilizados: Profesora Anarella Gatto.
Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.