Propiedades del agua
| Sitio: | Aulas | Uruguay Educa |
| Curso: | Química para la Gastronomía - 2020 |
| Libro: | Propiedades del agua |
| Imprimido por: | Invitado |
| Día: | miércoles, 2 de abril de 2025, 22:33 |
1. ¿Cuál es la estructura de la molécula de agua?
Analicemos la estructura de una molécula de agua...
En el caso del agua, el enlace químico (o fuerza intrapartícula) presente es el enlace covalente polar. Recordando lo analizado en el módulo 1 - Enlace Químico - el enlace covalente es la fuerza que mantiene unidos a los átomos formando moléculas. El oxígeno se encuentra compartiendo un par de electrones de valencia con cada hidrógeno.
Podemos decir que la molécula de agua es:
Triatómica: está compuesta por tres átomos,
Angular: el ángulo de enlace es de 104,45º,
Polar: cada molécula de agua tiene dos polos. Estos polos los podemos explicar por la diferencia de electronegatividad que existe entre el átomo de oxígeno y el de hidrógeno (ENO = 3,5 / ENH = 2,1). El átomo de oxígeno es el más electronegativo de los dos, por lo que genera a su alrededor una zona de alta densidad de carga negativa (representada como δ−). Alrededor de los átomos de hidrógeno se genera una zona de baja densidad de carga negativa (representada como δ+). Por eso se puede afirmar que la molécula de agua es un dipolo (molécula polar con dos polos eléctricos). Esto se debe a que cuando se unen dos átomos de elementos con marcada diferencia de electronegatividad, el par de electrones compartidos es más atraído por el átomo de mayor electronegatividad. O sea, el par de electrones no es compartido de igual forma por ambos átomos.
Modelo de dipolo
2. Enlace de hidrógeno
El caso de la molécula de agua:
Repasando, en el capítulo anterior estuvimos viendo que esta molécula es un dipolo, es decir, tiene un polo positivo (zona de los átomos de hidrógeno) y un polo negativo (zona del átomo de oxígeno).
El puente de hidrógeno (o enlace de hidrógeno) es una atracción del tipo dipolo-dipolo, donde el átomo de hidrógeno (polo positivo) perteneciente a una molécula, se encuentra atraído al átomo de oxígeno (polo negativo) de otra molécula cercana (recuerda que las cargas opuestas se atraen).
3. Estados de agregación del agua
Como seguramente recordarás, podemos hablar de tres estados de agregación principales de la materia: sólido, líquido y gas.
Podemos diferenciarlos desde el punto de vista macroscópico, pero en este caso repasaremos las diferencias a nivel ultra microscópico.
En el caso del estado sólido, las partículas se encuentran muy próximas entre sí, con escaso espacio vacío entre ellas, y una gran fuerza de atracción entre dichas partículas, las partículas se encuentran vibrando en su lugar.
En el estado líquido, las partículas se encuentran formando grupos variables, están más separadas entre sí que en la fase sólida, las fuerzas de atracción entre las partículas son menos intensas que en la fase sólida, y vibran, rotan y se trasladan.
En el estado gaseoso las partículas se encuentran muy separadas entre sí, con un gran espacio vacío entre ellas, las fuerzas de atracción entre las partículas son casi nulas, y se mueven con mayor rapidez que en el caso de las partículas de los líquidos, chocando entre sí y con las paredes del recipiente.
El caso del agua:
Observa el siguiente vídeo que modeliza la estructura de las distintas fases o estados de agregación del agua.
A diferencia de los demás sólidos en la naturaleza, en el caso de la fase sólida del agua (hielo) las moléculas se encuentran muy ordenadas formando huecos hexagonales entre ellas debido a los puentes o enlaces de hidrógeno. Esto hace que el espacio entre las partículas sea mayor que en la fase líquida.
Cuando el hielo se funde, un 15 % de los puentes o enlaces de hidrógeno se rompen y la red rígida colapsa. Algunas moléculas están libres, en fase líquida, para entrar en los huecos de dicha red.
En el caso del agua hablamos de vapor de agua y no de gas (el término vapor se aplica a la fase gaseosa de aquellas sustancias que a temperatura ambiente se encuentran líquidas o sólidas). El vapor de agua no es visible. ¿Qué es lo que observamos entonces cuando hierve el agua? Micro gotas que se forman debido a la condensación del vapor de agua (recuerda que hay una gran diferencia de temperatura entre el interior del recipiente donde se encuentra el agua y el ambiente).
4. Propiedades físicas y químicas del agua
Todos estamos familiarizados con el agua. Varias son las tareas que a diario realizamos y que emplean este compuesto. Sin ir más lejos, nuestro planeta está cubierto por más de un 70 % de agua, mientras que en el resto del Universo no se han encontrado rastros salvo en Marte y Júpiter.
Propiedades físicas: el agua pura es incolora, inodora e insípida. Su densidad es una de las propiedades más importantes (1 g/mL a 4 ºC), mientras que el agua sólida, presenta una menor densidad (0,92 g/mL), lo que explica el hecho de que el hielo flote en el agua. Su punto de fusión y ebullición, también son dos de las propiedades más relevantes. En la escala Celsius corresponden a 0 ºC y 100 ºC, respectivamente (a 1 atmósfera de presión).
Propiedades químicas: tienen que ver fundamentalmente con la capacidad del agua como solvente (para formar soluciones acuosas), y la posibilidad de reaccionar con óxidos ácidos, óxidos básicos, metales y no metales.
5. Proceso de hidratación
¿Qué ocurre cuando disolvemos sal de mesa en agua?
La sal de mesa, cloruro de sodio, es un compuesto iónico formado por cationes sodio (Na+) y aniones cloruro (Cl-). Al entrar en contacto con el agua, formada por moléculas polares, se separan dichos iones e interactúan con las moléculas de agua que los rodean.
En el caso del catión sodio con carga positiva, se ve atraído por el polo negativo (átomo de oxígeno) de las moléculas de agua que lo rodean. El anión cloruro con carga negativa, se atrae con los átomos de hidrógeno, es decir, el polo positivo de la molécula de agua. Esta interacción es llamada ion-dipolo.
Si el agua es el solvente utilizado, decimos que los iones se encuentran hidratados.
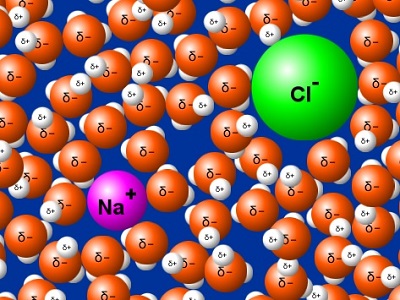
Imagen obtenida con el simulador PHET.