Química - 3º B.D.
¿Qué son la entalpía de formación y de combustión estándar?
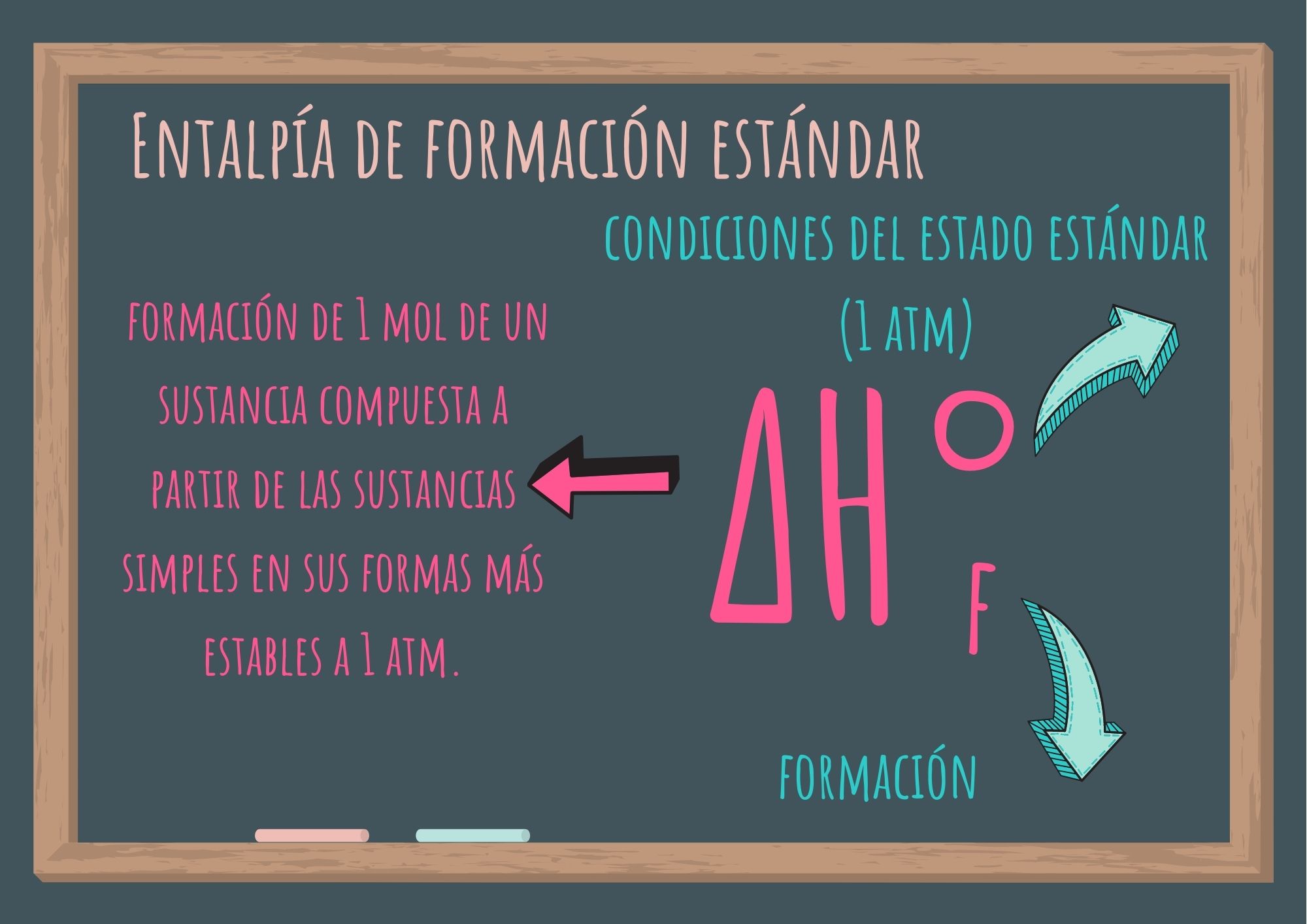
1. Entalpía de formación estándar
![]()
Se denomina entalpía de formación estándar a la variación de entalpía correspondiente a la formación de 1 mol de una sustancia compuesta a partir de las sustancias simples en sus formas más estables a 1 atm (presión de 1 atmósfera).
![]()
Se simboliza ΔH°f : donde el exponente "°" representa las condiciones del estado estándar (1 atm), y el subíndice "f", significa formación.
A pesar de que el estado estándar no especifica una temperatura, se suelen utilizar valores de ΔH°f medidos a 25,0 °C.
![]()
Por convención, la entalpía de formación estándar de cualquier sustancia simple en su forma más estable es igual a cero. Analicemos los siguientes ejemplos:
- Sustancias simples formadas por el elemento oxígeno: El dioxígeno (O2) es más estable que el ozono (O3), la otra forma alotrópica del oxígeno a 1 atm. Por lo que ΔH°f (O2) = 0 kJ/mol mientras que ΔH°f (O3) = 143 kJ/mol.
- Sustancias simples formadas por el elemento carbono: El grafito es una forma alotrópica del carbono más estable que el diamante a 1 atm, por lo tanto ΔH°f (C graf) = 0 kJ/mol y ΔH°f (Cdiam) = 1,9 kJ/mol.
Nota: Existen sustancias simples con propiedades diferentes pero formadas por el mismo elemento, llamadas variedades alotrópicas o alótropos. Si las propiedades características (punto de fusión, punto de ebullición, dureza, densidad, entre otras) son distintas significa que se trata de sustancias diferentes.
![]()
La entalpía de formación estándar del agua líquida es - 285,8 kJ/mol, lo que se representa:
H2 (g) + ½ O2 (g) → H2O (l)
ΔH°f (H2O, l) = - 285,8 kJ/mol
La entalpía de formación estándar del dióxido de carbono gaseoso es - 393,5 kJ/mol, lo que se representa:
C (graf) + O2 (g) → CO2 (g)
ΔH°f (CO2, g) = - 393,5 kJ/mol
La entalpía de formación estándar del metano gaseoso es - 74,9 kJ/mol, lo que se representa:
C (graf) + 2 H2 (g) → CH4 (g)
ΔH°f (CH4, g) = - 74,9 kJ/mol
La entalpía de formación estándar del etanol líquido es - 277,7 kJ/mol, lo que se representa:
2 C (graf) + 3 H2 (g) + ½ O2 (g) → C2H6O (l)
ΔH°f (C2H6O, l) = - 277,7 kJ/mol
La entalpía de formación estándar del óxido de magnesio sólido es - 601,6 kJ/mol, lo que se representa:
Mg (s) + ½ O2 (g) → MgO (s)
ΔH°f (MgO, s) = - 601,6 kJ/mol
Puedes consultar el siguiente enlace y encontrarás al final una tabla con la entalpía de formación estándar de varias sustancias.
![]()