Química - 3º B.D.
¿Qué son la entalpía de formación y de combustión estándar?
3. Introducción: tetraedro de fuego
3.1. Combustión
![]()
Es una reacción química de oxidación (pérdida de electrones) relativamente rápida que consiste en la reacción de un material combustible con el dioxígeno (comburente), con desprendimiento de energía, que se desarrolla en fase gaseosa o heterogénea.
La rapidez de la combustión depende:
- de la afinidad del combustible con el dioxígeno.
- y de las condiciones en las que se realice la combustión (tiempo, temperatura, entre otras).
Es esencial que los elementos que forman el combustible tengan gran afinidad con el elemento oxígeno. Los elementos carbono e hidrógeno, que forman parte de muchos combustibles, cumplen con este requisito.
![]()
Se puede hablar de dos tipos de combustión: completa e incompleta. A continuación se analizan las características de cada uno de estos procesos.
Una combustión es completa cuando se logra oxidar todo el combustible y se libera toda la energía. En una combustión completa todo el carbono y el hidrógeno, contenidos originalmente en el combustible, se convierten en dióxido de carbono (CO2) y en agua (H2O).
Mientras que en una combustión incompleta pueden emitirse moléculas del combustible sin reaccionar, partículas de carbono que no alcanzan a oxidarse, vapor de agua y, predominantemente, monóxido de carbono (CO).
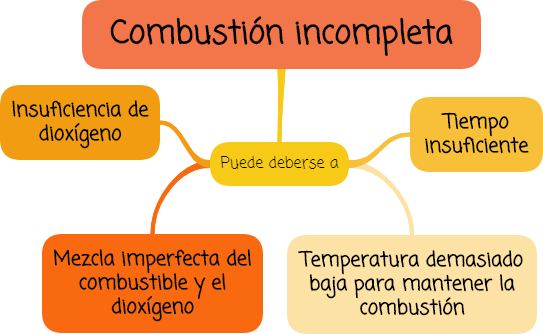
Una combustión incompleta puede deberse a:
- la insuficiencia de dioxígeno,
- mezcla imperfecta del combustible y el dioxígeno,
- tiempo insuficiente, y
- temperatura demasiado baja para mantener la combustión.