Química - 3º B.D.
¿Qué son la entalpía de formación y de combustión estándar?
3. Introducción: tetraedro de fuego
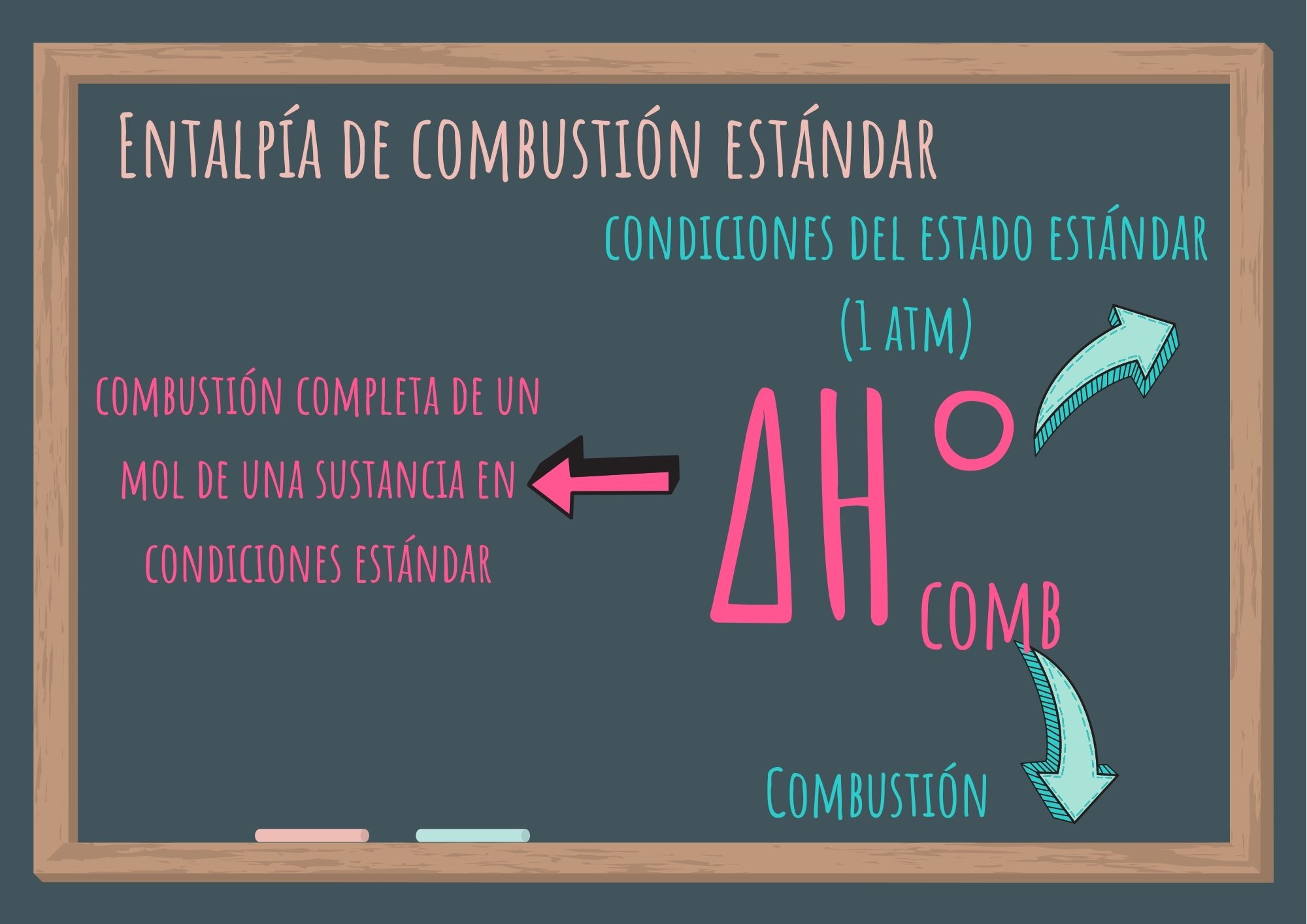
3.3. Entalpía de combustión estándar
![]()
Se denomina entalpía de combustión estándar a la variación de entalpía correspondiente a la combustión completa de un mol de una sustancia en condiciones estándar (presión de 1 atmósfera).
La combustión es un
proceso exotérmico donde se libera energía.
![]()
Se simboliza ΔH°comb: donde el exponente "°" representa las condiciones del estado estándar (1 atm), y el subíndice "comb", significa combustión.
A pesar de que el estado estándar no especifica una temperatura, se suelen utilizar valores de ΔH°comb medidos a 25,0 °C.
![]()
La entalpía de combustión estándar del metano gaseoso (componente del gas natural) es - 890,2 kJ/mol, lo que se representa:
CH4 (g) + 2 O2 (g) → 2 H2O (l) + CO2 (g)
ΔH°comb (CH4) = - 890,2 kJ/mol
La entalpía de combustión estándar del butano gaseoso es - 2657,3 kJ/mol, lo que se representa:
C4H10 (g) + 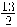 O2 (g) → 5 H2O (l) + 4 CO2 (g)
O2 (g) → 5 H2O (l) + 4 CO2 (g)
ΔH°comb (C4H10) = - 2657,3 kJ/mol
La entalpía de combustión estándar del octano líquido (componente de la gasolina) es - 5107,5 kJ/mol, lo que se representa:
C8H18 (l) + 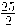 O2 (g) → 9 H2O (l) + 8 CO2 (g)
O2 (g) → 9 H2O (l) + 8 CO2 (g)
ΔH°comb (C8H18) = - 5107,5 kJ/mol
La entalpía de combustión estándar del dodecano líquido (componente del diésel) es - 7514,5 kJ/mol, lo que se representa:
C12H26 (l) + 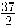 O2 (g) → 13 H2O (l) + 12 CO2 (g)
O2 (g) → 13 H2O (l) + 12 CO2 (g)
ΔH°comb (C12H26) = - 7514,5 kJ/mol
La entalpía de combustión estándar del oleato de metilo líquido (componente del biodiesel) es - 11094,4 kJ/mol, lo que se representa:
C19H36O2 (l) + 27 O2 (g) → 18 H2O (l) + 19 CO2 (g)
ΔH°comb (C19H36O2) = - 11094,4 kJ/mol
La entalpía de combustión estándar del etanol líquido es - 1234,8 kJ/mol, lo que se representa:
C2H6O (l) + 3 O2 (g) → 3 H2O (l) + 2 CO2 (g)
ΔH°comb (C2H6O) = - 1234,8 kJ/mol
![]()