Química - 3º B.D.
¿Qué son la entalpía de formación y de combustión estándar?
2. Entalpía de reacción estándar
![]()
La importancia de las entalpías estándar de formación radica en que, una vez que se conocen sus valores, se puede calcular la entalpía de reacción estándar, que se define como la variación de la entalpía de una reacción que se efectúa a 1 atm de presión. Es la variación de la entalpía de la reacción cuando los reactivos en su estado estándar se transforman en productos en su estado estándar.
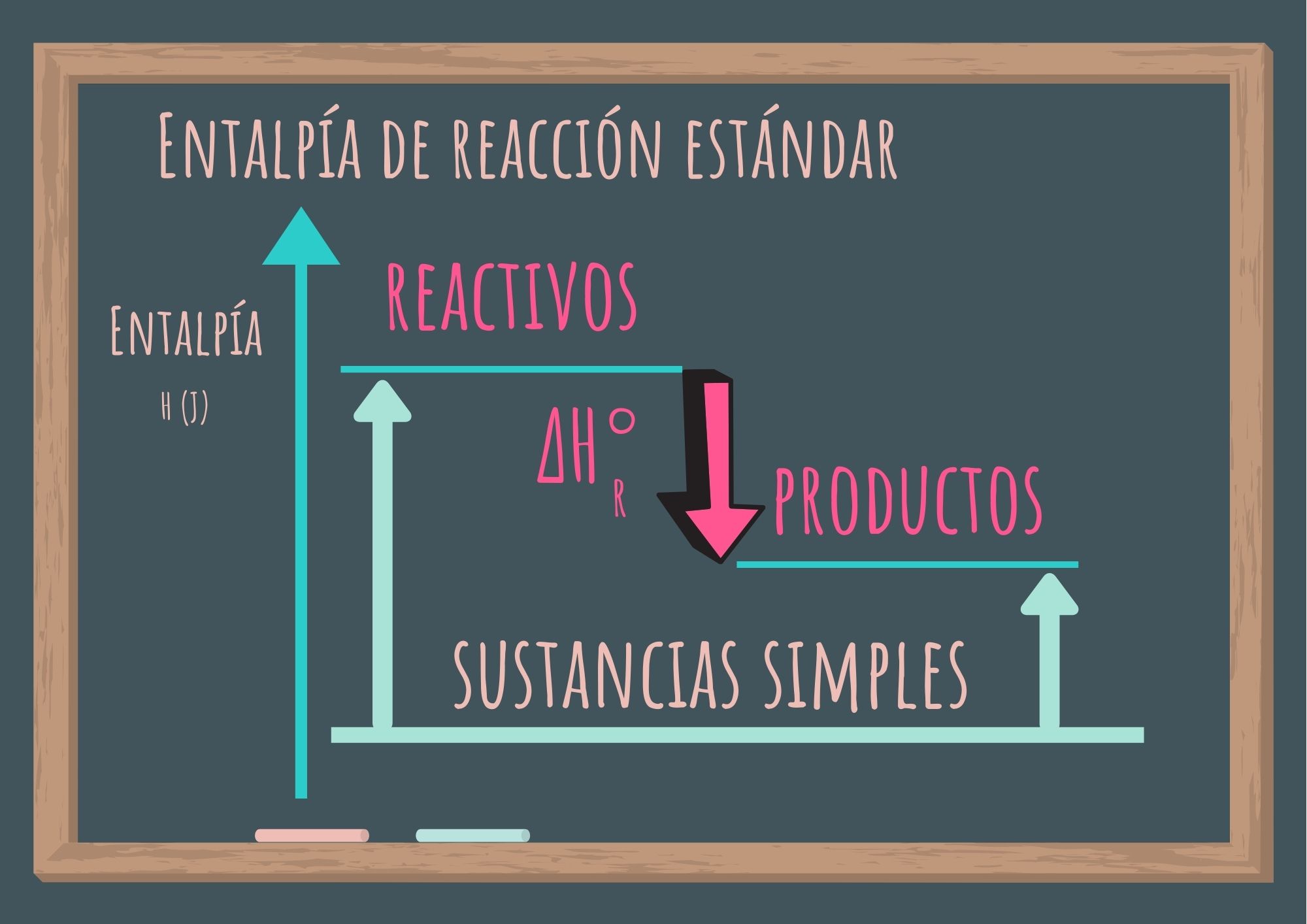
Como puedes observar en la gráfica anterior si conocemos la entalpía de formación estándar de las sustancias que participan como reactivos y de las sustancias que forman los productos (datos tabulados), haciendo la diferencia podemos encontrar la entalpía de reacción estándar.
![]()
Se simboliza ΔH°r : donde el exponente "°" representa las condiciones del estado estándar (1 atm), y el subíndice "r", significa reacción.
A pesar de que el estado estándar no especifica una temperatura, se suelen utilizar valores de ΔH°f medidos a 25,0 °C.
![]()
Por ejemplo, consideremos la reacción hipotética:
a A + b B → c C + d D
Siendo A y B: reactivos, C y D: productos.
Siendo a, b, c y d los coeficientes estequiométricos que se obtienen al igualar o balancear dicha expresión.
Para calcular ΔH°r podemos utilizar la siguiente expresión matemática:
ΔH°r = [c. ΔH°f (C) + d. ΔH°f (D)] - [a. ΔH°f (A) + b. ΔH°f (B)]
Se multiplica el coeficiente estequiométrico del producto 1 por la entalpía de formación estándar de ese producto (valor que aparecen en tablas), lo mismo se realiza para el producto 2, y el 3 si lo hubiere. Se suman los valores entre sí. Se lleva a cabo el mismo procedimiento para los reactivos y se suman los valores obtenidos entre sí. Finalmente, sabiendo que la variación es la diferencia entre el estado final y el inicial, se resta el valor obtenido para los productos y el valor obtenido para los reactivos. De esta forma se obtiene la entalpía estándar para la reacción química analizada.
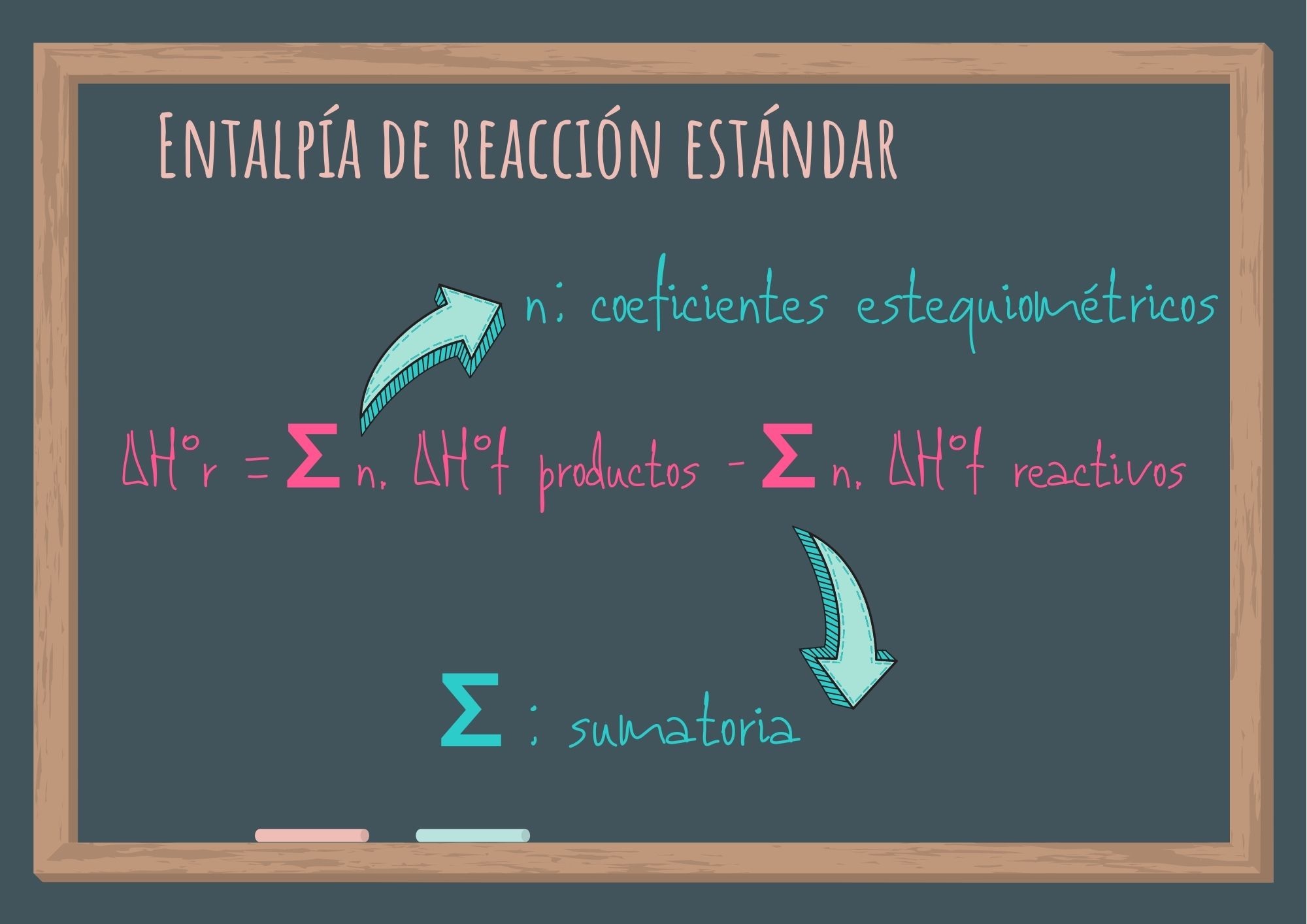
En general podemos utilizar la siguiente expresión matemática:
ΔH°r = ∑ n. ΔH°f productos - ∑ n. ΔH°f reactivos
Donde n representa los coeficientes estequiométricos y ∑ la suma de.
Para calcular ΔH°r se deben conocer los ΔH°f de las sustancias que intervienen en la reacción.
![]()
1. Calcular la entalpía de reacción estándar para el siguiente cambio:
2 NH3 (g) +
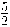 O2 (g) → 2 NO (g) + 3 H2O (g)
O2 (g) → 2 NO (g) + 3 H2O (g)
Primeramente consultamos la siguiente tabla (la tabla se encuentra al final de la página) para obtener las entalpías estándar de formación de cada una de las sustancias que intervienen. Recuerda revisar bien en la tabla tomando en cuenta el estado de agregación de cada una de las sustancias ya que varía la entalpía de formación estándar según el estado de agregación.
Productos:
- ΔH°f (NO, g) = 90,3 kJ/mol
- ΔH°f (H2O, g) = - 241,8 kJ/mol
Reactivos:
- ΔH°f (NH3, g) = - 45,9 kJ/mol
- ΔH°f (O2, g) = 0 kJ/mol
∑ n. ΔH°f productos = (2 mol. 90,3 kJ/mol) + (3 mol. - 241,8 kJ/mol)
∑ n. ΔH°f productos = 180,6 kJ - 725,4 kJ
∑ n. ΔH°f productos = - 544,8 kJ
Repetimos los pasos anteriores para los reactivos, tomando en cuenta nuevamente los coeficientes estequiométricos.
∑ n. ΔH°f reactivos = (2 mol. - 45,9 kJ/mol) + (2,5 mol. 0 kJ/mol)
∑ n. ΔH°f reactivos = - 91,8 kJ
Para finalizar utilizamos la siguiente expresión sustituyendo los resultados obtenidos en los pasos anteriores.
ΔH°r = ∑ n. ΔH°f productos - ∑ n. ΔH°f reactivos
ΔH°r = - 544,8 kJ - (- 91,8 kJ) = - 453,0 kJ
2. Calcular la entalpía de reacción estándar para el siguiente cambio:
NH3 (g) + HCl (g) → NH4Cl (s)
Primeramente consultamos la siguiente tabla (la tabla se encuentra al final de la página) para obtener las entalpías estándar de formación de cada una de las sustancias que intervienen. Recuerda revisar bien en la tabla tomando en cuenta el estado de agregación de cada una de las sustancias ya que varía la entalpía de formación estándar según el estado de agregación.
Producto:
- ΔH°f (NH4Cl, g) = - 314,5 kJ/mol
Reactivos:
- ΔH°f (NH3, g) = - 45,9 kJ/mol
- ΔH°f (HCl, g) = - 92,3 kJ/mol
∑ n. ΔH°f producto = 1 mol. -314,5 kJ/mol
∑ n. ΔH°f producto = - 314,5 kJ
Repetimos el paso anterior para los reactivos, tomando en cuenta nuevamente los coeficientes estequiométricos.
∑ n. ΔH°f reactivos = (1 mol. - 45,9 kJ/mol) + (1 mol. - 92,3 kJ/mol)
∑ n. ΔH°f reactivos = - 138,2 kJ
Para finalizar utilizamos la siguiente expresión sustituyendo los resultados obtenidos en los pasos anteriores.
ΔH°r = ∑ n. ΔH°f producto - ∑ n. ΔH°f reactivos
ΔH°r = - 314,5 kJ - (- 138,2 kJ) = - 176,3 kJ
![]()