Química - 3º B.D.
Ley de Hess y sus aplicaciones
2. Ley de Hess
![]()
Si ciertos reactivos se convierten en determinados productos (en las mismas condiciones), la variación de la entalpía tiene el mismo valor independientemente que el proceso se realice en uno o en varios pasos.
En otras palabras, es posible separar la reacción de interés en una serie de reacciones para las cuales se pueda medir el valor de ΔH°r y, de esta manera, calcular el ΔH°r para la reacción total (de interés).
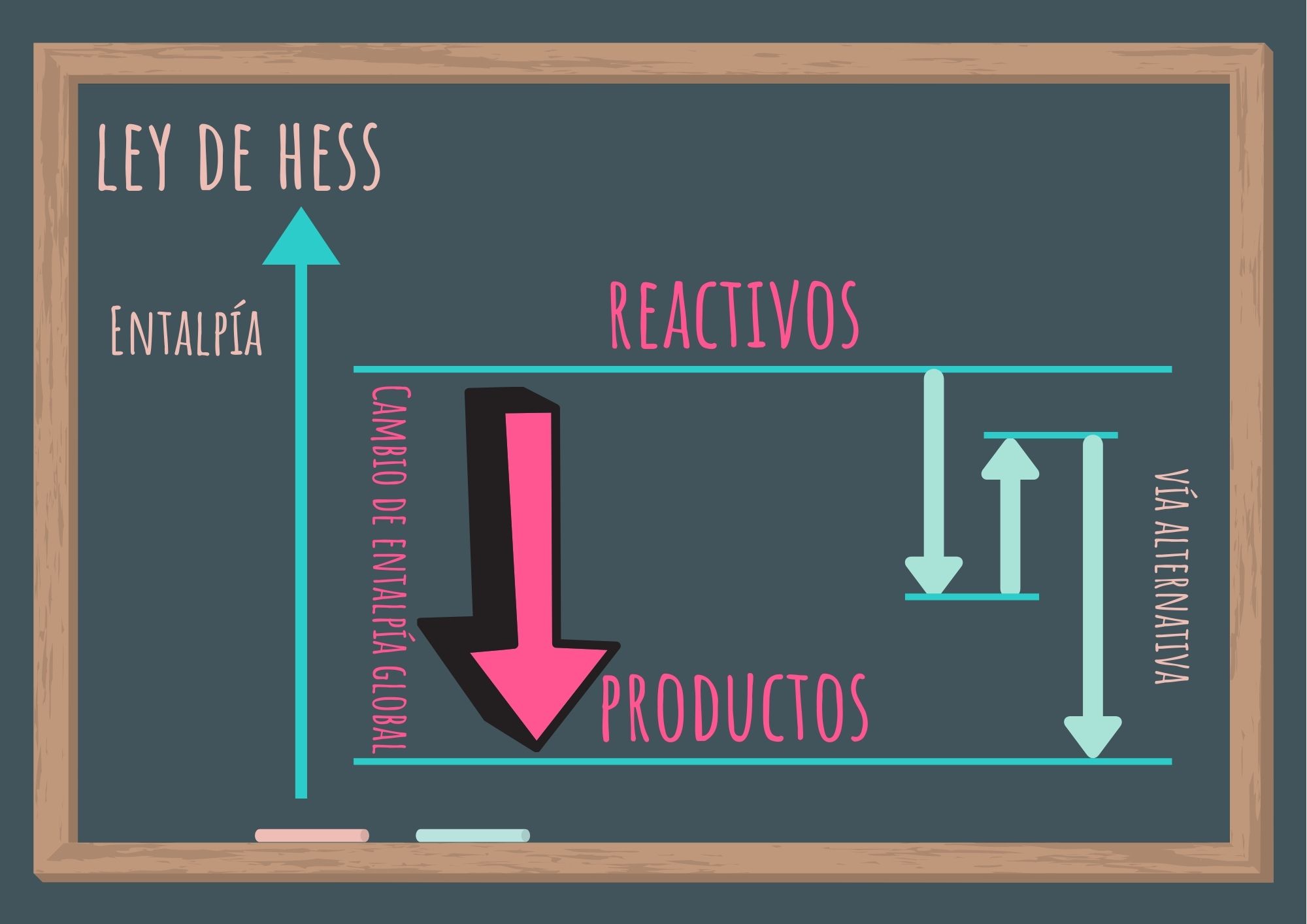
La ley de Hess no es otra cosa que la consecuencia de que la entalpía es una función de estado.
