Química - 3º B.D.
¿Qué son los catalizadores y los mecanismos de reacción?
1. Mecanismo de reacción
1.4. Ejemplo 2 - Formación de yoduro de hidrógeno
![]()
Un mecanismo de reacción común es aquel que incluye, por lo menos, dos pasos elementales, el primero de los cuales es muy rápido comparado con el segundo paso.
Un ejemplo lo constituye la reacción entre el dihidrógeno (H2) y el diyodo (I2) para producir yoduro de hidrógeno (HI).
H2 (g) + I2 (g) → 2 HI (g)
Experimentalmente se encontró que la ley de rapidez es:
r = k. [H2] . [I2]
![]()
Durante muchos años se pensó que la reacción era una reacción bimolecular que requería una molécula de dihidrógeno y una molécula de diyodo. Sin embargo, en la década del sesenta se encontró que el mecanismo real es más complejo. Se propuso un mecanismo en tres pasos:
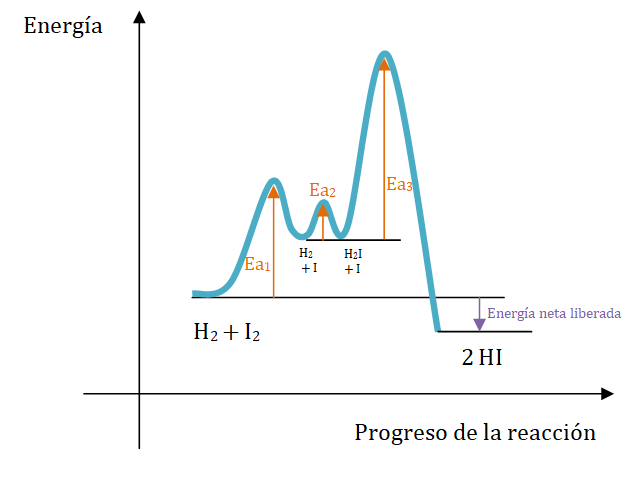
Paso 1: I2 → 2 I (rápido)
Paso 2: H2 + I → H2I (rápido)
Paso 3: H2I + I → 2 HI (lento)
__________________________________________________________
Reacción global: I2 + H2 + I + H2I + I → 2 I + H2I + 2 HI
![]()
Los átomos de yodo (I) son los intermediarios en esta reacción. Cuando inicia la reacción, hay muy pocos átomos de I presentes. Pero, a medida que el diyodo (I2) se disocia, disminuye su concentración mientras que la de I aumenta.
El paso 3 es el más lento, por lo que se le denomina el paso determinante.
Este mecanismo proporciona la ley de rapidez correcta para la reacción. Esta concordancia, además de la presencia de los átomos de yodo como intermediarios, constituye una fuerte evidencia para avalar este mecanismo como correcto.
![]()
En este caso ninguno de los reactivos originales aparecen en el paso determinante de rapidez, pero ambos aparecen en la expresión de la ley de rapidez. Cada paso es una reacción en sí misma y posee su energía de activación propia. Debido a que el paso 3 es el más lento, se sabe que su energía de activación es la más alta.
En la siguiente representación gráfica se observan las energías de activación relativas para el mecanismo postulado en la reacción en fase gaseosa: