Química - 3º B.D.
¿Qué son los catalizadores y los mecanismos de reacción?
2. Catálisis
![]()
La rapidez de muchas reacciones crece si aumenta la concentración de los reactivos o la temperatura. De manera similar, si la reacción es heterogénea se puede aumentar la rapidez mediante el aumento de la superficie de un reactivo. Si se desea aumentar la rapidez para determinada concentración o superficie sin elevar la temperatura se puede emplear un catalizador.
Un catalizador es una sustancia que aumenta la rapidez de una reacción sin ser "consumida" en la misma. El nombre proviene de las palabras griegas que significan "destrucción al reunirse". En muchos casos, solo se necesita una pequeña cantidad de catalizador, dado que actúa una y otra vez.
El catalizador acelera una reacción proporcionando un camino alternativo. o sea un mecanismo de reacción diferente, entre los reactivos y los productos. Este nuevo camino presenta una energía de activación más baja que la del camino original como se puede observar en la siguiente representación gráfica.
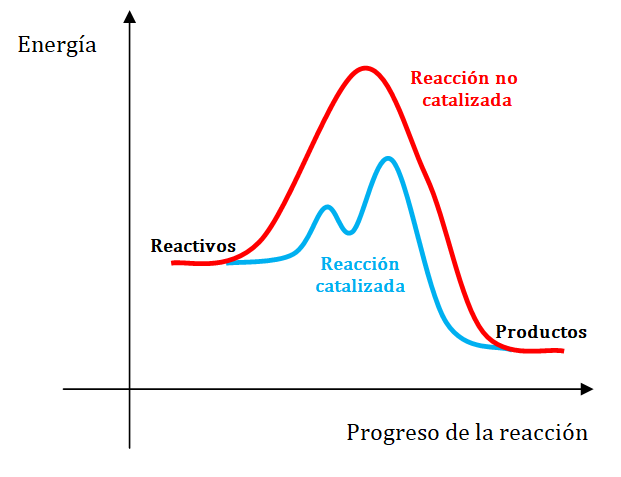
Observa el siguiente video:
![]()
Los múltiples catalizadores conocidos en la actualidad pueden ser clasificados según
varios criterios: estructura, composición, área de aplicación o estado de agregación. La
clasificación más habitual es la referente a los estados de agregación en que actúan los
catalizadores. Hay dos grandes grupos: catalizadores heterogéneos y homogéneos.
También existen formas intermedias tales como los catalizadores homogéneos ligados a
sólidos, dentro de los cuales se incluyen el grupo de los biocatalizadores. La forma de catálisis más importante es con mucho la heterogénea; de hecho, el mercado de los
catalizadores homogéneos supone sólo entre un 10 y un 15 % del total.
Se puede hablar de tres tipos de catálisis:
- catálisis homogénea
- catálisis heterogénea
- catálisis enzimática (puedes repasar las características de este tipo de catálisis en el siguiente enlace)
A continuación se analizarán los dos primeros.
