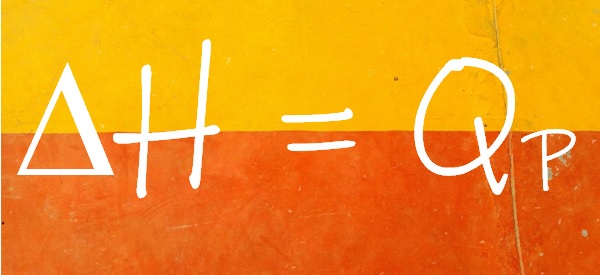Química - 3º B.D.
¿Qué es la entalpía?
2. Interpretación de las transferencias de energía: entalpía
En termoquímica se identifica el calor liberado o absorbido a presión constante (QP) con la variación de una propiedad del sistema, llamada entalpía, que se simboliza con la letra H. El cambio de entalpía de un sistema durante una reacción química es igual al calor liberado o absorbido a presión constante.
![]()
La mayoría de las reacciones químicas y cambios físicos tienen lugar a presión constante (normalmente la atmosférica).
La entalpía de un sistema disminuye si durante una transformación a presión constante se libera calor (Q). La entalpía de un sistema aumenta si durante una transformación a presión constante se absorbe Q.
La variación de entalpía se determina: ∆H = H final – H inicial / ∆H = H productos – H reactivos
- En un proceso exotérmico ∆H es menor a cero. ∆H<0
- ¿Qué ocurre a nivel ultramicroscópico en un proceso exotérmico? Observa la siguiente Animación 1
- En un proceso endotérmico ∆H es mayor a cero. ∆H>0
- ¿Qué ocurre a nivel ultramicroscópico en un proceso endotérmico? Observa la siguiente Animación 2