Química - 3º B.D.
¿Qué estudia la cinética química? ¿Qué es la rapidez de una reacción?
3. Determinación de la variación de la concentración
3.1. Ejemplo 1
![]()
Un ejemplo, el dibromo acuoso (de color anaranjado) reacciona con el ácido metanoico (conocido comúnmente como ácido fórmico ya que se encuentra presente en las hormigas) formándose aniones bromuro (incoloros), cationes hidrógeno y dióxido de carbono gaseoso. La siguiente ecuación representa dicho proceso:
Br2 (ac) + HCOOH (ac) → 2 Br-
(ac) + 2 H+
(ac) + CO2 (g)
En la imagen anterior puedes observar cómo varía la coloración de la muestra al transcurrir el tiempo.
En colorimetría se mide la intensidad del color de una solución como el dibromo acuoso de color anaranjado. Para ello se coloca en un tubo una solución de dibromo de concentración conocida con ácido metanoico en exceso y se coloca en un espectrofotómetro (imagen superior que se encuentra a continuación) o en un fotocolorímetro (imagen inferior).

En el caso del fotocolorímetro está formado por una lámpara que emite luz blanca, en todas las longitudes de onda, dicha luz pasa por una rendija que produce un haz estrecho que pasa por un filtro para permitir que solamente la luz de una longitud de onda específica pase. ¿Cómo seleccionar el color del filtro? Se selecciona el color complementario al color de la solución (recuerda que el color que observamos es el color que no absorbió el sistema y es reflejado por el mismo), en este caso el color complementario al anaranjado es el azul. En la siguiente figura puedes ver cuáles son los colores complementarios.
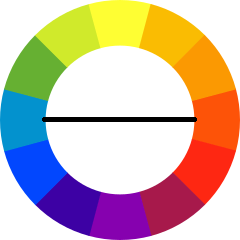
Inicialmente debido a la alta concentración de dibromo una gran cantidad de luz azul es absorbida por la muestra y la cantidad de luz que atraviesa la muestra es baja por lo que la señal detectada por el fotocolorímetro es baja. Al avanzar la reacción disminuye la concentración de dibromo [Br2] y su color se desvanece. Cuanto mayor sea la cantidad de luz absorbida por la muestra es directamente proporcional a la concentración del dibromo acuoso. Con estos datos se puede calcular la rpromedio (r: rapidez):
rpromedio = - [Br2]final - [Br2]inicial / tfinal - tinicial
Al calcular la rpromedio a intervalos cada vez más cortos se obtiene la rinstantánea (ri).
La rapidez también depende de la concentración de ácido metanoico o
fórmico (HCOOOH). Sin embargo, al agregarlo en exceso a la mezcla se puede asegurar que la concentración de ácido metanoico permanece prácticamente constante durante el transcurso de la reacción. El cambio en la cantidad de
ácido no tiene efecto en la rapidez medida.
Cuadro de datos obtenidos de realizar la actividad experimental:
| t (s) | [Br2] (mol/L) | r (mol/L.s) | k = r /[Br2] (1/s) |
|---|---|---|---|
| 0,0 | 0,01200 | 4,20 . 10-5 | |
| 50,0 | 0,01010 | 3,52 . 10-5 | |
| 100,0 | 0,00846 | 2,96 . 10-5 | |
| 150,0 | 0,00710 | 2,49 . 10-5 | |
| 200,0 | 0,00596 | 2,09 . 10-5 | |
| 250,0 | 0,00500 | 1,75 . 10-5 | |
| 300,0 | 0,00420 | 1,48 . 10-5 | |
| 350,0 | 0,00353 | 1,23 . 10-5 | |
| 400,0 | 0,00296 | 1,04 . 10-5 |
- Calcula el valor de la última columna (k). ¿Qué puedes decir al respecto?
- Construye una gráfica de la concentración de dibromo acuoso en función del tiempo.
- Busca información sobre cómo se puede calcular la rapidez a partir de la gráfica anterior.
- Construye también una gráfica de la rapidez en función de la concentración de dibromo acuoso.
- ¿Qué puedes concluir al respecto de la segunda gráfica?
