Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 9: Unidades de concentración
- Módulo 9: Unidades de concentración
Módulo 9: Unidades de concentración

En el módulo anterior estuvimos repasando el concepto de solución química. Vimos también que podemos clasificar a las soluciones en diluidas, concentradas o saturadas. Podemos ser aún más específicos indicando la proporción entre soluto y solvente, por ejemplo.
FORMAS Y UNIDADES USADAS PARA EXPRESAR LA CONCENTRACIÓN DE LAS SOLUCIONES:
Existen algunas formas para expresar la concentración de una solución muy utilizadas por la comunidad científica. A continuación analizaremos algunas de ellas.
- Masa de soluto en una unidad de volumen de solución (C)
Esta forma relaciona la masa del soluto y el volumen de la solución. La podemos calcular utilizando la siguiente expresión matemática:
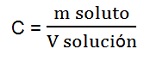
Es muy común utilizar las siguientes unidades: masa de soluto en gramos (g), volumen de la solución en litro (L "mayúscula") y por lo tanto concentración en gramos por litro (g/L).
En el caso de las soluciones muy diluídas se puede utilizar la unidad ppm (partes por millón) o sea mg/L, siendo mg: miligramos.
Por ejemplo: Si tenemos una solución compuesta por 6,34 g de cloruro de sodio disueltos en 450 mL (recuerda que el volumen deberá estar expresado en litro) de solución su concentración será:
C = 6,34 g / 0,450 L
C = 14,1 g/L.
- Porcentaje en masa (% m/m)
Esta forma indica la masa de soluto presente en 100 unidades de masa de solución. No presenta unidad. Podemos calcular dicho porcentaje utilizando la siguiente expresión matemática:
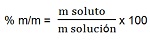 Por ejemplo: una solución de ácido nítrico tiene una concentración de 40 % m/m, esto significa que si tenemos 100 g de solución, 40 g son de ácido nítrico, los 60 g restantes corresponden al solvente que en este caso es el agua.
Por ejemplo: una solución de ácido nítrico tiene una concentración de 40 % m/m, esto significa que si tenemos 100 g de solución, 40 g son de ácido nítrico, los 60 g restantes corresponden al solvente que en este caso es el agua.- Porcentaje en volumen (% V/V)
En el caso de que tanto el soluto como el solvente se encuentren líquidos se suele utilizar esta otra forma. No presenta unidad. Para calcular el porcentaje en volumen utilizamos la siguiente expresión matemática:
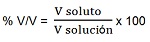 Recuerda que al utilizar la expresión anterior deberás expresar ambos volúmenes en la misma unidad.
Recuerda que al utilizar la expresión anterior deberás expresar ambos volúmenes en la misma unidad.Esta forma es muy utilizada en el caso de las bebidas alcohólicas (soluciones de etanol o "alcohol etílico"). La unidad, en este caso, se denomina grado Gay-Lussac y se representa º GL.
1 ºGL = 1 % V/V
Por ejemplo: un vino tiene una graduación alcohólica de 14 º GL, esto quiere decir que su concentración de etanol es de 14 % V/V, hay 14 mL de etanol por cada 100 mL del vino.

Material extraído y adaptado de: Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012) Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto.
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
