Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 18: Procesos exotérmicos y endotérmicos
- Módulo 18: Procesos exotérmicos y endotérmicos
Módulo 18: Procesos exotérmicos y endotérmicos

La termoquímica estudia aquellas transformaciones que se acompañan de liberación o de absorción de calor.
El calor, es la energía transferida, a través de paredes conductoras, entre un sistema y su ambiente (o entre sistemas en contacto) cuando sus temperaturas son diferentes. Es un mecanismo de intercambio de energía.
Calor se simboliza con la letra Q. La unidad en el sistema internacional de unidades para calor es Joule y se simboliza con la letra J. En termoquímica es frecuente expresar el calor en kilojoules (kJ). Cotidianamente es común usar otra unidad del calor, la caloría (cal).
Equivalencias: 1kJ – 1000 J 1kcal – 1000 cal 1 cal – 4,18 J
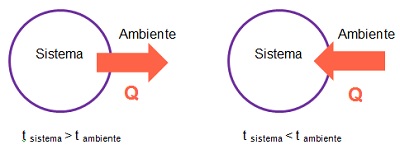
Como puedes observar en la imagen anterior, si un sistema se encuentra a mayor temperatura que el ambiente, la energía en forma de calor se transfiere desde el sistema hacia el ambiente. Por el contrario si la temperatura del sistema es menor que la del ambiente, la energía en forma de calor se transfiere desde el ambiente hacia el sistema.
Es posible determinar si un sistema gana o pierde energía en forma de calor según se produzca en el ambiente o entorno una disminución o aumento de temperatura respectivamente.
Clasificación termoquímica de las reacciones
Las reacciones químicas que ocurren con la liberación de energía se denominan exotérmicas, mientras que las que ocurren con la absorción de energía se denominan endotérmicas.
Por ejemplo cuando encendemos la estufa, se libera energía proveniente de la combustión de la leña, es por lo tanto un proceso exotérmico. Mientras que para cocinar un alimento se absorbe energía, siendo un proceso endotérmico.


Interpretación de las transferencias de energía
En termoquímica se identifica el calor liberado o absorbido a presión constante con la variación de una propiedad del sistema, llamada entalpía, que se simboliza con la letra H. El cambio de entalpía de un sistema durante una reacción química es igual al calor liberado o absorbido a presión constante.
La entalpía de un sistema disminuye si durante una transformación a presión constante se libera calor (Q). La entalpía de un sistema aumenta si durante una transformación a presión constante se absorbe Q.
La variación de entalpia se determina: ∆H = H final – H inicial
- En un proceso exotérmico ∆H es menor a cero. ∆H<0
- En un proceso endotérmico ∆H es mayor a cero. ∆H>0
Por ejemplo:
1. La combustión completa del metano, se puede representar por la siguiente ecuación termoquímica:
CH4 (g) + 2 O2(g) → CO2 (g) + 2 H2O(l) ∆H = - 890,4 kJ/mol.
Esto significa que por cada mol de metano (CH4) que se quema se liberan 890,4 kJ. Es un proceso exotérmico.
2. La formación de la hidracina se puede representar por la siguiente ecuación termoquímica:
2 H2(g) + N2(g) → N2H4 (g) ∆H = + 95,4 kJ/mol.
Esto significa que por cada mol de hidracina (N2H4) formada se absorben 95,4 kJ. Es un proceso endotérmico.
Diagrama entálpico
En termoquímica se denomina diagrama entálpico a la gráfica que permite representar los cambios de entalpía en las reacciones químicas. Un diagrama entálpico se construye en un par de ejes cartesianos; en el eje de las ordenadas se representa la entalpía (H) y en el de las abscisas el avance de la reacción. Los siguientes diagramas entálpicos representan de forma genérica un proceso endotérmico y uno exotérmico.
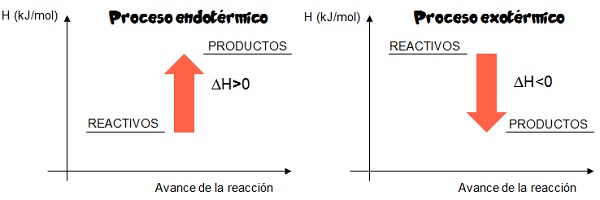
Material extraído y adaptado de: Saravia, G., Segurola, B., Franco, M. y Nassi, M. (2012) Todo se transforma. Química- 4º Año (1º BD). Montevideo, Uruguay: Contexto
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
