Química - 1º B.D.
- Introducción
Introducción


Los siguientes Módulos de Aprendizaje fueron diseñados para uso de docentes y estudiantes de Primer año de Bachillerato en la asignatura Química.
Tienen la característica de constituirse en específicas unidades de conocimiento que facilitan su abordaje.
Se pueden usar como complemento a las actividades de aula, tareas domiciliarias o compensatorias. También en el caso de que el docente deba faltar a sus clases y desee realizar actividades de recuperación.
Los módulos han sido diseñados por los profesores: Anarella Gatto, Sebastián Mendieta y Melody García.
Agradecemos las sugerencias y correcciones de los Profesores Analía Otte, Karen González, Laura Condratiuk y Raúl Britos.
Contacto:
- agatto@uruguayeduca.edu.uy
Licencia: Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Si desea descargar el curso completo para restaurarlo en su aula personal haga clic en el archivo que aparece a continuación.
De lo contrario en cada uno de los módulos encontrará el archivo en formato mbz de dicho módulo.
_______________________________________________________
- agatto@uruguayeduca.edu.uy
Módulo 1: Enlace químico
- Módulo 1: Enlace químico
Módulo 1: Enlace químico

En el curso de 3º (Química), estudiaste que solamente los gases nobles se encuentran en la Naturaleza como átomos aislados. Pero la gran mayoría de los elementos forman enlaces químicos con otros: la molécula de agua posee dos átomos de hidrógeno que se encuentran enlazados a un átomo de oxígeno.
Los átomos se agrupan para formar estructuras con propiedades muy distintas de las que presentan en su forma elemental.

Refiriéndonos a un ejemplo concreto, el carbono y el oxígeno pueden enlazarse químicamente para formar dióxido de carbono (CO2), o monóxido de carbono (CO) que es un gas tóxico. En ambos casos intervienen los mismos elementos, dando lugar a sustancias con diferentes estructuras y propiedades, dependiendo de la naturaleza y características de ese enlace, y del número de átomos que intervengan.
¿Por qué razones los átomos se unen?
Los átomos permanecen unidos por fuerzas de naturaleza eléctrica. Si bien los átomos son eléctricamente neutros, cuando se acercan unos a otros, se producen nuevas interacciones eléctricas que dan lugar al enlace.
Las fuerzas que dan lugar al enlace son interacciones atractivas.
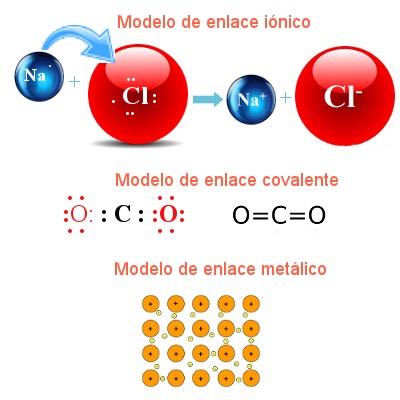
Existen tres tipos de enlaces químicos: iónico, covalente y metálico.
- El enlace iónico es la atracción electrostática entre iones de cargas opuestas, en la imagen puedes observar la formación del catión sodio Na+ y el anión cloruro Cl- (el electrón de valencia o electrón de enlace del átomo de sodio es transferido al átomo de cloro formándose los iones correspondientes).
- En el enlace covalente los pares de electrones son compartidos por los átomos formando moléculas (pueden compartirse de manera igual - enlace covalente apolar, o desigual - enlace covalente polar). En la imagen se representa a la molécula de dióxido de carbono, como puedes observar el átomo de carbono comparte dos de sus electrones de valencia con cada átomo de oxígeno.
- El enlace metálico es la atracción entre los cationes metálicos fijos y los electrones móviles.
Evalúa tu comprensión
Aplicando las TIC
Para docentes
_________________________________________
