Formato rejilla
Material de lectura
1. Equilibrio químico
1.3. K: constante de equilibrio
Este proceso puede generalizarse con la siguiente reacción reversible, siendo a,b,c y d los coeficientes estequiométricos de las especies reactivas A, B, C y D a una temperatura dada:
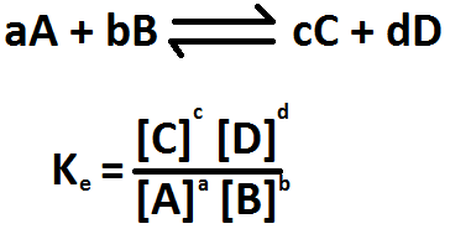
Donde K es la CONSTANTE DE EQUILIBRIO. La ecuación anterior es la expresión matemática de la ley de acción de las masas, propuesta por los químicos noruegos Cato Guldberg y Peter Waage, en 1864. Esta ley establece que para una reacción incompleta en equilibrio y a una temperatura constante, una relación determinada de concentraciones de reactivos y productos tiene un valor constante K (la constante de equilibrio).
- Aunque
las concentraciones pueden variar, el valor de K para una reacción dada
permanece constante, siempre y cuando la reacción esté en equilibrio y la
temperatura no cambie.
- K
no tiene unidades.
Valor de K:
- sólo
varía con la temperatura
- es constante a una T (temperatura) dada
- es
independiente de las concentraciones iniciales.
