Química - 3º B.D.
¿Cómo funciona un calorímetro y una bomba calorimétrica?
5. Resolución de ejercicios: Ejemplo 1
5.3. Ejemplo 4
![]()
¿Cuál es el calor para la combustión completa de una muestra de 1,4350 g de naftaleno (C10H8) en una bomba calorimétrica cuya capacidad calorífica es de 1,80 kJ/ºC, si la temperatura de los 2000 g de agua en su interior aumentó de 20,17 ºC a 25,84 ºC? Recuerda que Ce agua = 4,18 J/g ºC. ¿Y en kJ/mol?
- Identificar los datos que da la letra:
Ce agua = 4,18 J/g.°C
mnaftaleno= 1,4350 g
magua = 2000 g
Ti = 20,17 °C
Tf = 25,84 °C
ΔT= Tf - Ti ΔT= 25,84 - 20,17 = 5,67 °C
K = 1,80 kJ/ºC
- Planteo:
QV combustión = QV agua + QV K
Q absorbido por el agua a volumen constante (QV agua):
QV agua = m . Ce . ΔT
QV agua = 2000 g . 4,18 J/g.°C . 5,67 °C = 47401 J o 47,4 kJ
Q absorbido por la bomba calorimétrica a volumen constante (QV K):
QV K = K . ΔT
QV K = 1,80 kJ/°C . 5,67 °C = 10,2 kJ
Q combustión a volumen constante (QV combustión):
QV combustión = 47,4 kJ + 10,2 kJ = 57,6 kJ
- Al quemarse 1,4350 g de naftaleno se liberaron 57,6 kJ, ¿cuál el calor liberado al quemarse un mol (expresado en kJ/mol)?
Es necesario calcular la masa molar del naftaleno. Repasa cómo hacerlo en el siguiente enlace.
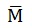 C10H8 = 128 g/mol
C10H8 = 128 g/mol
Con este dato y la masa se puede calcular la cantidad química (n) de naftaleno: n = m / 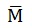
n = 1,4350 g / 128 g/mol = 0,0112 mol
Se liberaron 57,6 kJ en la combustión de 0,0112 mol de naftaleno, por lo que 1 mol de naftaleno: QV combustión por mol = QV combustión / n
QV combustión por mol = 57,6 kJ / 0,0112 mol = 5143 kJ/mol
