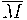Aula de apoyo para estudiantes 1º BG - 2018 - Pando
Algunos conceptos teóricos
4. Gas: Variables de estado
- Temperatura (T): magnitud que se mide con un termómetro. Unidades: Celsius o Kelvin.

Conversión diferentes escalas termométricas: para practicar
- Presión (P): fuerza por unidad de superficie. Unidades: mm de Hg, hPa, atm, bar.
- Volumen (V): una magnitud que nos permite conocer cuánto "lugar" ocupa en el espacio. Unidades: mL (cm3) o L.
- Cantidad química (n): magnitud que relaciona la masa de una sustancia con la masa molar de la misma. Unidad: mol
m: masa expresada en gramos (g)
![]() : masa molar expresada en gramos por mol (g/mol)
: masa molar expresada en gramos por mol (g/mol)
Simulador (repasa las partes 1 2 y 3)
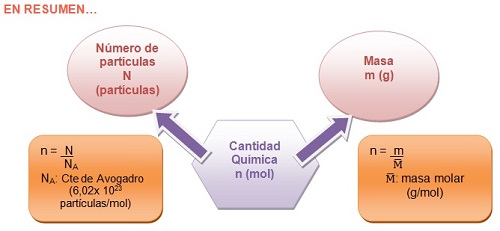
Una magnitud que muchas veces usamos en Química es la cantidad química, cuyo símbolo es n y su unidad es el mol en el SI.
El mol, se define como "la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos de carbono hay en 0,012 kg de carbono-12" (IUPAC 1967, BOE de 3-11-1989).
La expresión "entidades elementales" refiere a átomos, moléculas, iones, electrones u otras partículas con dimensiones del orden ultramicroscópico.
El número de átomos que hay en 12 g de carbono puro es 6,02 x 1023. Este número se conoce como Constante de Avogadro, en honor al científico italiano Amadeo Avogadro. Este número es muy grande pues corresponde a 602.000 trillones.
La magnitud cantidad química es directamente proporcional al número de partículas presentes en una muestra. Ambas magnitudes se relacionan mediante la constante de Avogadro.
Expresión matemática: N = n x NA n = N / NA
Por ejemplo:
1. ¿Cuántas moléculas hay en 3,40 mol de agua?
Aplicando la expresión matemática: N = n x NA
N = 3,40 mol x 6,02.1023 = 2,0468 .1024
Redondeando 2,05.1024 moléculas de agua
2. ¿Qué cantidad química de cloruro de sodio hay en 2,45 .1023 partículas?
Aplicando la expresión matemática n = N / NA
n = 2,45 . 1023 / 6,02 . 1023 = 0,4069
Redondeando 0,407 mol.
La cantidad química (n) y la masa (m) de una sustancia, se relacionan a través de la masa molar.
Es importante tener en cuenta que por definición, la Masa Molar de un elemento es la masa de un mol del mismo expresada en gramos y la unidad es g/mol.
Para poder saber la Masa Molar de un compuesto, debemos sumar las masas molares de todos los elementos que lo conforman.
Por ejemplo:

La magnitud cantidad química es directamente proporcional a la masa molar.
En resumen: