Formato rejilla
Material de lectura
2. Termoquímica
La termoquímica estudia aquellas transformaciones que se acompañan de liberación o de absorción de calor.
El calor, es la energía transferida, a través de paredes conductoras, entre un sistema y su ambiente (o entre sistemas en contacto) cuando sus temperaturas son diferentes. Es un mecanismo de intercambio de energía.
Calor se simboliza con la letra Q. La unidad en el sistema internacional de unidades para calor es Joule y se simboliza con la letra J. En termoquímica es frecuente expresar el calor en kilojoules (kJ). Cotidianamente es común usar otra unidad del calor, la caloría (cal).
Equivalencias: 1kJ – 1000 J 1kcal – 1000 cal 1 cal – 4,18 J
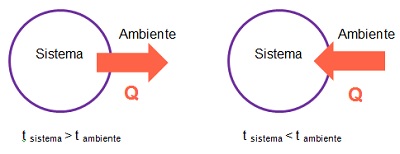
Como puedes observar en la imagen anterior, si un sistema se encuentra a mayor temperatura que el ambiente, la energía en forma de calor se transfiere desde el sistema hacia el ambiente. Por el contrario si la temperatura del sistema es menor que la del ambiente, la energía en forma de calor se transfiere desde el ambiente hacia el sistema.
Es posible determinar si un sistema gana o pierde energía en forma de calor según se produzca en el ambiente o entorno una disminución o aumento de temperatura respectivamente.
