Química - 1º B.D.
Actividad 1: Simulando procesos endotérmicos y exotérmicos
PARA PENSAR...
¿Qué crees que ocurre al mezclar 50 mL de agua a 27°C con 50 mL de agua a 47°C?
BUSCA INFORMACIÓN:
¿Qué es un calorímetro y para qué se utiliza?
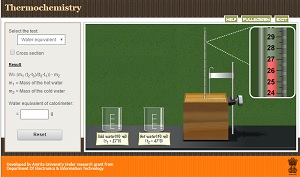
SIMULADOR
A partir del siguiente simulador resuelve las actividades a continuación.
Para poder utilizarlo deberás crearte un usuario.
Actividades:
A- MEZCLANDO AGUA
1. En la opción select the test aparecerá water equivalent.
Si marcas la casilla cross section podrás ver el interior del calorímetro.
Arrastra el primer vaso de bohemia hasta el calorímetro y vuelca su contenido en el interior del mismo.
2. Repite el procedimiento con el segundo vaso de bohemia.
3. Anota la temperatura final.
4. ¿Coincide con tu respuesta a la primera pregunta de esta página? ¿Por qué crees que ocurrió eso?
B- DISOLVIENDO UNA SAL
1. En la opción select the test selecciona enthalpy of dissoluttion
Te aparecerá una sección (select the sample) en donde puedes elegir la sal que utilizarás.
Comencemos con ammonium chloride o sea cloruro de amonio NH4Cl.
Coloca los 50 mL de agua en el interior del calorímetro y anota la temperatura inicial (ti).
2. Coloca los 5 g de cloruro de amonio y observa cuál es la temperatura final alcanzada (tf).
3. ¿Cuál es la variación de la temperatura Δt? Recuerda que Δt = tf - ti, o sea la resta entre la temperatura final y la inicial.
4. Repite los pasos anteriores para las demás sales:
- Potassium chloride - Cloruro de potasio KCl
- Potassium nitrate - Nitrato de potasio KNO3
- Copper sulphate pentahydrate - Sulfato cúprico pentahidratado CuSO4.5 H2O
5. Completa el siguiente cuadro:
Nombre de la sal disuelta | Fórmula química de la sal | Masa disuelta m (g) | Temperatura inicial ti (ºC) | Temperatura final tf (ºC) | Variación de la temperatura Δt (ºC) | Tipo de proceso: exotérmico / endotérmico |
|---|---|---|---|---|---|---|
| 1- | ||||||
| 2- | ||||||
| 3- | ||||||
| 4- |
Escribe tus respuestas en un archivo de texto y súbelo a la tarea como archivo adjunto.
