Química - 3º B.D.
¿Qué son las enzimas?
1. Introducción
1.2. ¿Qué son las enzimas?
![]()
Las enzimas son los catalizadores de las reacciones de los sistemas biológicos, catalizan casi todas las reacciones químicas que tienen lugar en los organismos vivos. Tienen un alto grado de especificidad, aceleran reacciones químicas específicas y funcionan en soluciones acuosas en condiciones muy suaves de temperatura y pH. Actuando en secuencias organizadas catalizan cientos de reacciones consecutivas en las rutas metabólicas mediante las que se degradan nutrientes, se conserva y transforma energía y se fabrican macromoléculas a partir de precursores sencillos. Son importantes en la medicina, industria química, en el tratamiento y preparación de alimentos, la agricultura y en la limpieza.
![]()
Una reacción no catalizada en una célula tiene lugar con el tiempo, pero no a una rapidez suficiente para la supervivencia. Por ejemplo, la hidrólisis de proteínas en los alimentos ocurriría con el tiempo sin un catalizador, pero las reacciones no ocurrirían con suficiente rapidez para satisfacer los requisitos corporales de aminoácidos. Las reacciones químicas en las células ocurren increíblemente rápido bajo condiciones leves, cerca de un pH de 7,4 y una temperatura corporal de 37 °C. Las enzimas permiten que las células utilicen energía y materiales de manera eficiente mientras responden a las necesidades celulares.
Como catalizadores, las enzimas reducen la energía de activación de una reacción química. Se necesita menos energía para convertir moléculas reactantes en productos, lo que aumenta la rapidez de una reacción bioquímica comparada con la rapidez de las reacciones no catalizadas. Algunas enzimas pueden aumentar la rapidez de una reacción biológica por un factor de mil millones, un billón o incluso miles de millones de billones en comparación con la rapidez de la reacción no catalizada. Por ejemplo, una enzima en la sangre llamada anhidrasa carbónica cataliza la interconversión rápida de dióxido de carbono (CO2) y agua (H2O) en anión hidrógenocarbonato (HCO3-) y catión hidrógeno (H+). En un segundo, una molécula de anhidrasa carbónica puede catalizar la reacción de aproximadamente un millón de moléculas de dióxido de carbono. La anhidrasa carbónica también cataliza la reacción inversa y convierte hidrógenocarbonato y H+ en dióxido de carbono y agua.
![]()
Con la excepción de un pequeño grupo de moléculas de ARN catalítico, todas las enzimas son proteínas. Las estructuras primaria, secundaria, terciaria y cuaternaria de las proteínas enzimáticas son esenciales para su actividad catalítica. Casi todas las enzimas son proteínas globulares. Cada una tiene una forma tridimensional única que reconoce y une un pequeño grupo de moléculas reactantes que se llaman sustratos. La estructura terciaria de una enzima tiene una importante función en la manera como dicha enzima cataliza reacciones.
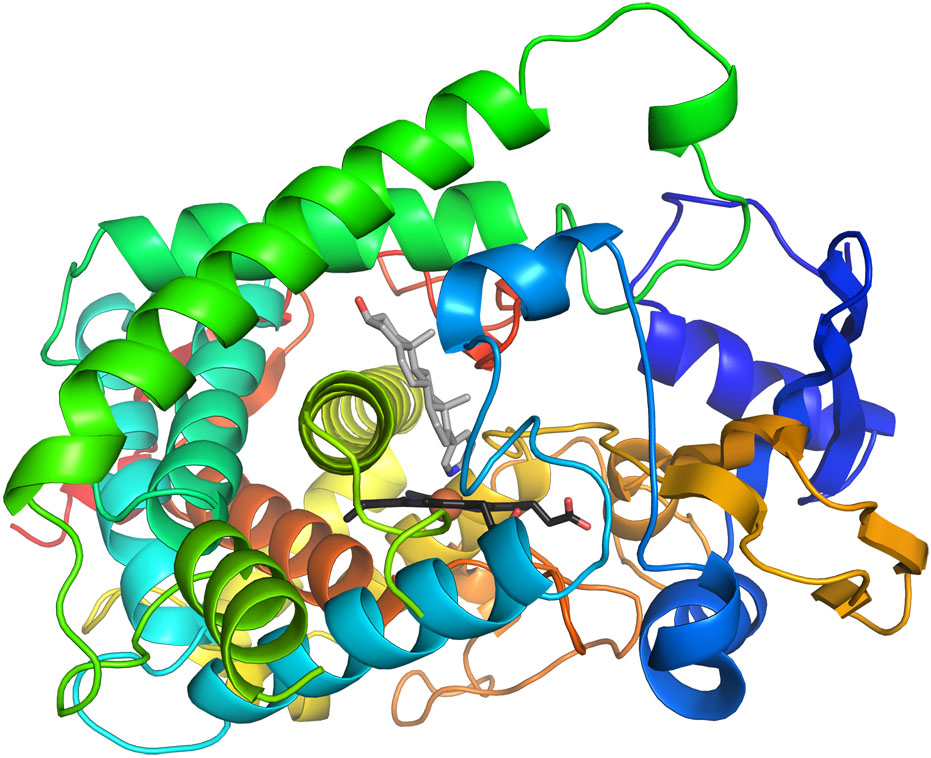
En una reacción catalizada, una enzima tiene que unirse a un sustrato en una forma que favorezca la catálisis.
![]()
Una enzima característica es mucho más grande que su sustrato. Sin embargo, dentro de la estructura terciaria de la enzima hay una región llamada sitio activo, donde se mantienen el o los sustratos mientras se realiza la reacción. Con frecuencia el sitio activo es una pequeña "bolsa" dentro de la estructura terciaria más grande. En el interior del sitio activo de una enzima, grupos R de aminoácidos específicos interaccionan con grupos funcionales del sustrato para formar enlaces de hidrógeno, puentes salinos e interacciones hidrofóbicas.
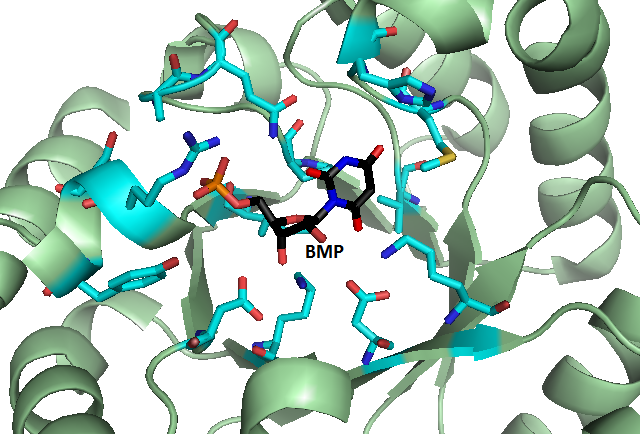
Puesto que el sitio activo de una enzima se acomoda a un tipo particular de sustrato, las enzimas generalmente catalizan sólo tipos específicos de reacciones. Algunas enzimas muestran especificidad absoluta al catalizar sólo una reacción para un sustrato específico. Otras enzimas catalizan una reacción para dos o más sustratos similares. Incluso hay otras enzimas que catalizan una reacción para un tipo de enlace específico.
