Química - 3º B.D.
¿Qué son las enzimas?
2. Modelos de acción enzimática
![]()
Los estudios muestran que solo una pequeña porción de una molécula enzimática, llamada sitio activo, participa en la interacción con un sustrato o sustratos durante una reacción. El sitio activo es la parte relativamente pequeña de la estructura de una enzima que realmente participa en la catálisis.
El sitio activo en una enzima es una entidad tridimensional formada por grupos que provienen de diferentes partes de la cadena de proteínas. Estos grupos se unen mediante el plegado y la flexión de la proteína.
La combinación de una enzima y un sustrato forma un complejo enzima-sustrato (ES), que proporciona una ruta alternativa para la reacción con una menor energía de activación. Dentro del complejo enzima-sustrato, el sustrato encuentra condiciones de reacción más favorables que si estuviera libre, el resultado es una formación más rápida del producto. En el interior del sitio activo las cadenas laterales de aminoácidos catalizan la reacción para producir un complejo enzima-producto (EP), luego se liberan los productos y la enzima está disponible para unirse a otra molécula de sustrato.
E + S ⇄ Complejo ES → Complejo EP → E + P
![]()
Para tener en cuenta la forma altamente específica en que una enzima reconoce un sustrato y lo une al sitio activo, los investigadores han propuesto varios modelos.
![]()
El más simple de estos modelos es el modelo de cerradura y llave.
En el modelo de cerradura y llave, el sitio activo en la enzima tiene una conformación geométrica fija y rígida. Solo los sustratos con una geometría complementaria pueden acomodarse en dicho sitio, de la misma manera que una cerradura acepta solo ciertas llaves. La siguiente figura ilustra el concepto:
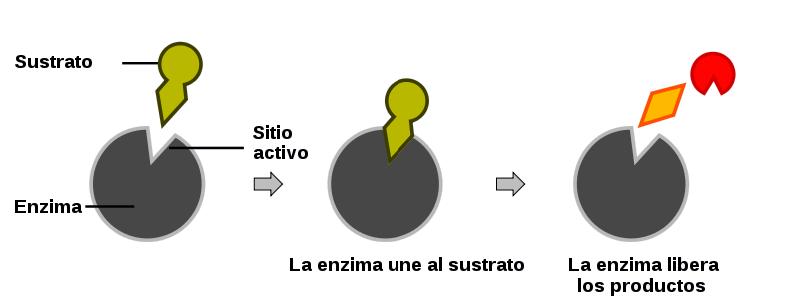
El modelo de cerradura y llave explica la acción de numerosas enzimas. Sin embargo, es demasiado restrictivo para la acción de muchas otras enzimas. La evidencia experimental indica que muchas enzimas tienen flexibilidad en sus formas, no son rígidas y estáticas, sino que hay un cambio constante en su forma. El modelo de ajuste inducido se utiliza para este tipo de situación.
![]()
El modelo de ajuste inducido permite pequeños cambios en la forma o geometría del sitio activo de una enzima para acomodar un sustrato. Una buena analogía son los cambios que ocurren en la forma de un guante cuando se inserta una mano en él. El ajuste inducido es el resultado de la flexibilidad de la enzima, ya que se adapta para aceptar el sustrato entrante. Este modelo es una explicación más exhaustiva de las propiedades del sitio activo de una enzima porque incluye la especificidad del modelo de cerradura y llave junto con la flexibilidad del carácter proteico de la enzima. La siguiente figura ilustra el concepto:
Las fuerzas que atraen el sustrato al sitio activo son muchas de las mismas fuerzas que mantienen la estructura terciaria en el plegamiento de las cadenas peptídicas. Las interacciones electrostáticas, los enlaces de hidrógeno y las interacciones hidrofóbicas ayudan a atraer y unir moléculas de sustrato. Por ejemplo, un grupo amino cargado positivamente (NH3+) en un sustrato podría ser atraído y retenido en el sitio activo por un residuo de aspartato o glutamato cargado negativamente. Además, algunos iones metálicos con carga positiva a menudo ayudan a unir las moléculas del sustrato.
