Química - 2º B.D.
Profundizando en los procesos de fusión y solidificación
4. Cambios de fases en relación con la temperatura y la presión: Diagramas de fases
![]()
Un diagrama de fases es un mapa que muestra cuál es la fase más estable a diferentes presiones y temperaturas en un sistema cerrado.
Las líneas que separan las regiones en el diagrama se denominan límites de fase, en cualquier punto sobre un límite entre dos regiones, las dos fases vecinas coexisten en equilibrio dinámico.
El diagrama es una gráfica bidimensional, con presión y temperatura en los ejes, y contiene tres curvas importantes, cada una de las cuales representa las condiciones de temperatura y presión en las que las distintas fases pueden coexistir en equilibrio. La única sustancia presente en el sistema es aquella cuyo diagrama de fases se está considerando. La presión que se indica en el diagrama es la que se aplica al sistema o la que la sustancia misma genera.
Comúnmente el diagrama de fases no se encuentra a escala.
A continuación se representa una diagrama de fases general.
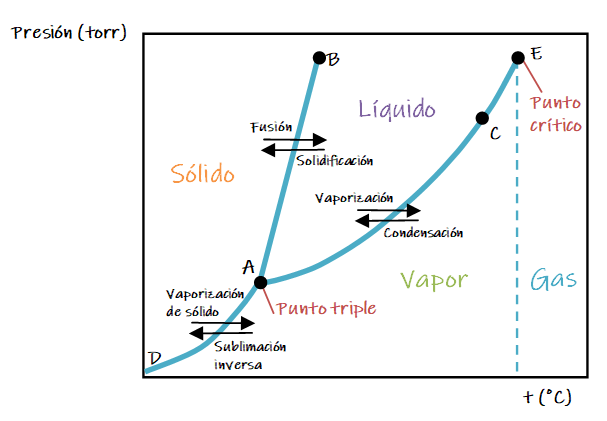
![]()
Las curvas pueden describirse como sigue:
1. La línea de A a C (AC) es la curva de presión de vapor del líquido; representa el equilibrio entre las fases líquida y vapor. El punto de esta curva en el que la presión de vapor es de 1 atm es el punto de ebullición normal de la sustancia. La curva de presión de vapor termina en el punto crítico (E), que está en la temperatura crítica y la presión crítica de la sustancia. Más allá del punto crítico, no es posible distinguir las fases líquida y gaseosa.
2. La línea AD representa la variación de la presión de vapor del sólido al sublimarse a diferentes temperaturas.
3. La línea AB representa el cambio del punto de fusión del sólido al aumentar la presión. Esta línea suele tener una pequeña pendiente hacia la derecha al aumentar la presión porque, para la mayoría de las sustancias, el sólido es más denso que el líquido. Un aumento en la presión por lo regular favorece la fase sólida, más compacta; por ello, se requieren temperaturas más altas para fundir el sólido a presiones más altas. El punto de fusión de una sustancia es igual a su punto de solidificación. La única diferencia entre los dos es la dirección desde la que nos aproximamos al cambio de fase. El punto de fusión a 1 atm es el punto de fusión normal.
El punto A, donde se intersecan las tres curvas, se conoce como punto triple. A esta temperatura y presión, las tres fases están en equilibrio.
Cualquier otro punto de las tres curvas representa un equilibrio entre dos fases. Cualquier punto del diagrama que no cae en una línea corresponde a condiciones en las que solo está presente una fase. La fase vapor, por ejemplo, es estable a baja presión y alta temperatura, mientras que la fase sólida es estable a temperaturas bajas y presiones altas. Los líquidos son estables en la región entre las otras dos.
