Química - 2º B.D.
Profundizando en los procesos de fusión y solidificación
1. Introducción
1.1. Ejemplo 1: Fusión y solidificación del agua
![]()
Como ya has visto en otros cursos de Química, el agua está formada por moléculas triatómicas, angulares y polares (dipolos). Las atracciones que se dan entre sus moléculas, o interacciones interpartícula, son los enlaces de hidrógeno (también conocidos como puentes de hidrógeno) que determinan las propiedades físicas del agua. Estas interacciones interpartícula hacen que el agua presente diferencias en sus propiedades frente a otras sustancias en la naturaleza y nos permite explicar por qué el hielo flota en el agua líquida.
![]()

¿Qué ocurre a nivel de partículas? Inicialmente las moléculas de agua que forman al hielo se encuentran vibrando. Cuando el hielo se funde, un 15 % de los enlaces de hidrógeno se rompen y la red rígida colapsa. Algunas moléculas están libres, en fase líquida, para entrar en los huecos de dicha red. Puedes observar esto en el siguiente video.
Cuando la temperatura alcanza el punto de fusión, las moléculas tienen energía suficiente para moverse unas por delante de otras. A esta temperatura, toda la energía agregada se usa para superar las fuerzas de atracción entre las moléculas. A nivel macroscópico se observa que el sistema va aumentando su temperatura gradualmente, luego por unos instantes la temperatura se mantiene constante, para luego comenzar a aumentar nuevamente.
Así, aunque el sistema continúe absorbiendo energía, la temperatura de la muestra de agua permanecerá constante en el punto de fusión hasta que todo el hielo se haya fundido. Solo entonces la temperatura se elevará nuevamente y la elevación continuará en ascenso hasta alcanzar el punto de ebullición. En este punto la elevación de la temperatura se detiene otra vez. Ahora las moléculas de agua tienen energía suficiente para escapar en el estado de vapor y toda la energía absorbida se emplea para formar el vapor. Después de que la muestra se ha vaporizado y continúa la absorción de energía, la temperatura del vapor se eleva nuevamente.
![]()
Por encima de 4 ºC la energía cinética de las moléculas de agua permite que se formen y rompan los enlaces de hidrógeno entre las mismas rápidamente. Pero por debajo de esta temperatura, la energía cinética de las moléculas de agua decae por debajo de la energía necesaria para formarse un enlace de hidrógeno, por tanto estos enlaces se forman con mucho más frecuencia de los que se rompen y esto hace que las moléculas adopten una estructura de huecos hexagonales entre las mismas, como puedes ver en la siguiente figura,
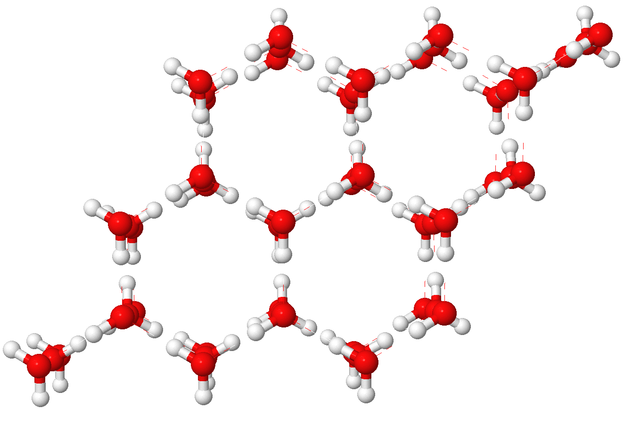
Un líquido se solidifica (congela) cuando sus partículas tienen energías tan bajas que son incapaces de deslizarse por fuera de los límites de sus vecinas. En el sólido, las partículas vibran en torno a sus posiciones promedio pero rara vez se mueven de un lugar a otro.
