Química - 2º B.D.
Profundizando en los procesos de fusión y solidificación
2. Curvas de calentamiento y enfriamiento
Es posible estudiar cuantitativamente el proceso de fusión o solidificación de una muestra e ir registrando la temperatura del sistema a distintos intervalos de tiempo. Con los datos obtenidos se puede construir una gráfica que represente estos procesos.
![]()
Una curva de calentamiento es una gráfica que permite observar la variación de la temperatura de una muestra a medida que el sistema absorbe energía a un ritmo y presión constantes (proceso endotérmico).
![]()
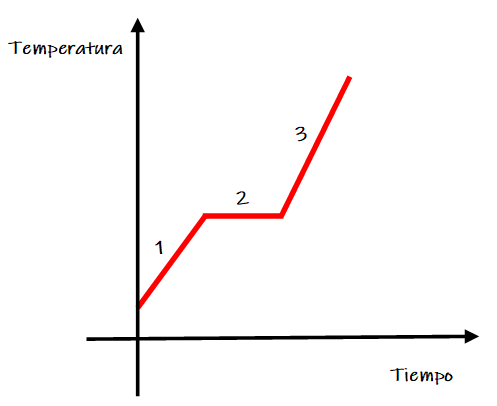
- Análisis macroscópico:
Al observar la gráfica de fusión se observan las siguientes zonas:
Zona 1. Aumenta la temperatura de la muestra sólida.
Zona 2. Se produce el cambio de estado de agregación de sólido a líquido, durante este intervalo de tiempo coexisten ambos estados físicos (sólido y líquido) y la temperatura permanece constante.
Zona 3. La muestra se encuentre en estado líquido y aumenta su temperatura.
La temperatura de la zona 2 se corresponde al punto de fusión de la sustancia. Por encima o por debajo de esta temperatura, todo el sistema se encuentra en un único estado de agregación.
- Análisis a nivel de partículas:
Zona 2. En el momento que algunas de las partículas del sólido tienen suficiente energía para vencer las fuerzas de atracción que las mantienen unidas, comienza el cambio de estado, es decir la fusión. Macroscópicamente la temperatura no varía porque la energía absorbida por las partículas es usada para vencer dichas fuerzas atractivas y no para aumentar su movimiento.
Zona 3. Las partículas continúan aumentando su energía cinética y pueden realizar movimientos de vibración, rotación y traslación.
![]()
Una curva de enfriamiento es una gráfica que permite observar la variación de la temperatura de una muestra a medida que el sistema libera energía a un ritmo y presión constantes (proceso exotérmico).
![]()
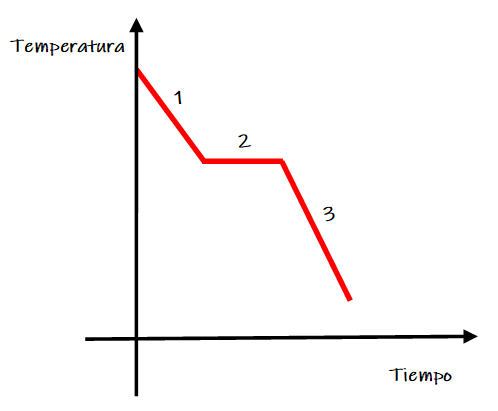
- Análisis macroscópico:
Al observar la gráfica de solidificación se observan las siguientes zonas:
Zona 1. Disminuye la temperatura de la muestra líquida.
Zona 2. Se produce el cambio de estado de agregación de líquido a sólido, denominado solidificación. Durante este intervalo de tiempo coexisten ambos estados físicos (líquido y sólido) y la temperatura permanece constante.
Zona 3. La muestra se ha solidificado y su temperatura desciende.
La temperatura de la zona 2 se denomina punto de solidificación.
- Análisis a nivel de partículas:
Zona 2. En el momento que algunas de las partículas de la muestra disminuyen su energía cinética por debajo de la energía necesaria para formarse las interacciones interpartícula, estas interacciones se forman con más frecuencia de lo que se rompen.
Zona 3. Las partículas continúan disminuyendo su energía cinética y pueden realizar movimientos de vibración sin cambiar su posición.
![]()
El punto de fusión (PF) de un sólido cristalino es la temperatura a la que un sólido se encuentra en equilibrio dinámico con su propio líquido a cierta presión.
El punto de solidificación (PS) o congelación es la temperatura a la cual los estados líquidas y sólidas están en equilibrio dinámico, varía levemente a medida que cambia la presión.
Para una misma sustancia, en iguales condiciones de presión, el punto de fusión es igual al punto de solidificación. El nombre solamente depende de en qué sentido se está dando el cambio.
Si la presión es de 1 atm (atmósfera) se denomina punto de fusión normal. Lo mismo ocurre para el caso del punto de solidificación normal.
Para conocer el punto de fusión o solidificación de una sustancia se puede recurrir a una curva de calentamiento o enfriamiento e identificar la zona de la gráfica denominada meseta, en la que la temperatura de la muestra no varía.
