Química - 2º B.D.
Profundizando en los procesos de fusión y solidificación
4. Cambios de fases en relación con la temperatura y la presión: Diagramas de fases
4.2. Ejemplo 2: Diagrama de fases parcial del dióxido de carbono
![]()
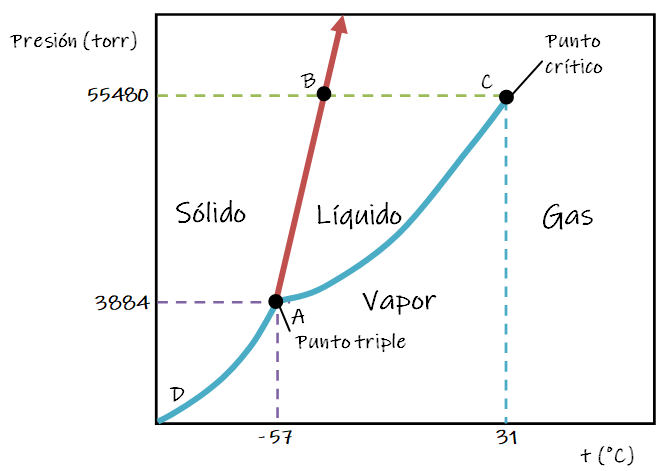
En el diagrama de fases parcial del dióxido de carbono, es posible ver que la curva (AB) corresponde a las diferentes condiciones de equilibrio dinámico entre sólido y líquido, o lo que es lo mismo, distintas temperaturas de fusión a diferentes presiones. La curva (AC), corresponde a diferentes condiciones de equilibrio dinámico entre líquido y vapor, es decir distintas temperaturas de ebullición a diferentes presiones. La curva (AD), corresponde a diferentes condiciones de equilibrio dinámico entre sólido y vapor, o lo que es lo mismo distintas temperaturas de sublimación a diferentes presiones. El punto de corte de las tres curvas, (A), corresponde a las condiciones del punto triple sólido-líquido-vapor.
En el caso del dióxido de carbono el sólido es más denso que el líquido, la línea de equilibrio sólido-líquido (AB) tiene pendiente positiva, esto es, arriba y a la derecha. Esto es cierto para casi todas las sustancias.
A presiones por debajo de la presión del punto triple, la fase líquida no existe; en su lugar, la sustancia pasa de manera directa de sólido a vapor o bien ocurre lo contrario (se depositan cristales del gas). A temperaturas y presiones a lo largo de AD, el sólido y el vapor están en equilibrio. En el siguiente video puedes observar lo que ocurre cuando se coloca un trozo de hielo seco (dióxido de carbono sólido) en un matraz Erlenmeyer que contiene agua a temperatura ambiente.
El punto triple tiene lugar a una presión de 3884 torr y - 57 °C. Esta presión es superior a la presión atmosférica, por lo que el dióxido de carbono líquido no puede existir
a presión atmosférica.
El punto C, cuyas coordenadas son: P = 55480 torr y t = 31°C, se denomina punto crítico, y sus coordenadas se denominan presión crítica y temperatura crítica respectivamente. Ambas corresponden a las máximas presión y temperatura a la que pueden coexistir en equilibrio dinámico un líquido con su propio vapor. En dichas condiciones, el vapor se encuentra tan comprimido que su densidad se iguala con la del líquido, por lo cual la interfase líquido-vapor desaparece.
