Química - 3º B.D.
¿Qué son las enzimas?
1. Introducción
![]()
Algunos procesos químicos, como las etapas iniciales de la visión, la fotosíntesis y las reacciones nucleares en cadena, ocurren muy rápidamente. Otros, como la polimerización del cemento y la conversión del grafito en diamante, necesitan millones de años para completarse. Una manera de cuantificar esto es a partir de la rapidez de reacción, que se define como el cambio en la concentración de un reactivo o de un producto con respecto del tiempo (mol/L.s).
En un nivel práctico, el conocimiento de la rapidez de las reacciones es de gran utilidad para el diseño de fármacos, el control de la contaminación y el procesamiento de alimentos.
La rapidez de una reacción química depende de la barrera de energía que debe salvarse en el proceso de convertir reactivos en productos. En una reacción química, las moléculas necesitan cierta energía mínima para romper enlaces existentes y formar los nuevos. Esta energía se denomina energía de activación (Ea) y se define como la mínima cantidad de energía que se requiere para iniciar una reacción química.
Consideremos por ejemplo la reacción de conversión de metil-isonitrilo a acetonitrilo:
![]()
Como puede verse, lo que debe ocurrir durante la reacción es el cambio de posición del carbono y el nitrógeno en el grupo nitrilo (C≡N), y lo podemos imaginar en forma de un "giro" de esta parte de la molécula. Luego de haberse estudiado a detalle se encontró que esta reacción transcurre en etapas:
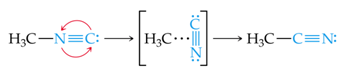
Observamos que, en la conversión, existe un momento en el que la parte N≡C de la molécula se encuentra "de costado". Es correcto suponer que es necesario suministrar energía a la molécula para que se alargue el enlace entre el grupo H3C y el grupo N≡C para que este grupo pueda girar. Una vez que este ha girado lo suficiente se comienza a formar el enlace C-C y la energía de la molécula desciende. Estas variaciones de energía pueden observarse en el siguiente diagrama:
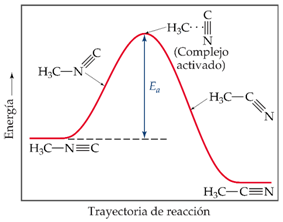
La barrera que existe para que se dé esta reacción es la energía que se necesita para forzar a la molécula a que pase por el estado intermedio, que es relativamente inestable, y así llegar al producto final. La diferencia entre la energía de la molécula inicial y la máxima energía a lo largo de la trayectoria de reacción es la energía de activación. La disposición particular de los átomos en la cima de la barrera se conoce como el complejo activado o estado de transición.
