Química - 3º B.D.
Actividad 1: Estudio cinético de la reacción entre iodato de potasio y sulfito de sodio
Introducción
En la actividad experimental simulada a continuación se estudia el efecto de la concentración de un reactivo en la rapidez de una reacción química analizando la reacción entre el iodato (o yodato) de potasio y el sulfito de sodio. En medio ácido, el anión iodato es reducido a ioduro por la acción del sulfito. Escribe una reacción que represente el proceso global. Luego de repasar sobre los procesos redox, indica qué cambios se dan en los números de oxidación de las especies intervinientes.
El objetivo de la misma es analizar el efecto de la concentración de uno de los reactivos en el tiempo de reacción.
Busca información sobre los siguientes aspectos:
- ¿Con qué objetivo se utiliza la solución de almidón?
Trabajando con el simulador
A partir del siguiente simulador resuelve las actividades a continuación.
Para poder utilizarlo deberás crearte un usuario.
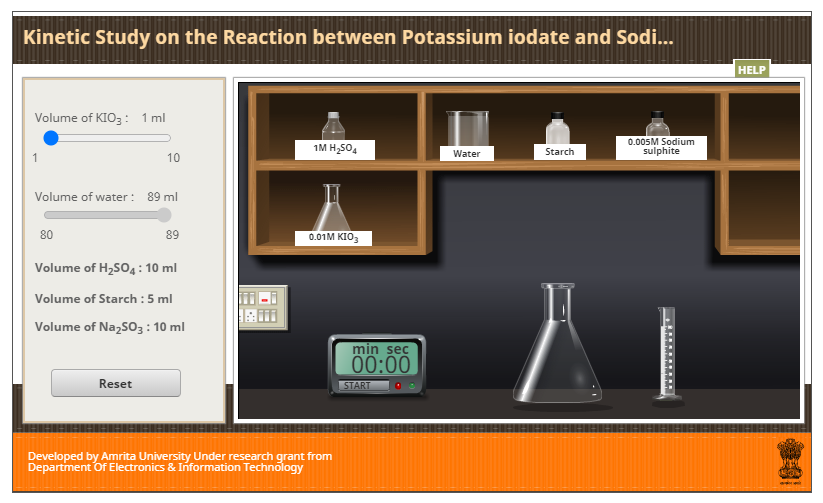
El sitio cuenta con diferentes pestañas: theory o teoría, procedure o procedimiento, animation o animación, simulator o simulador (que es en la que deberás trabajar) y video, entre otros. La propuesta se encuentra en inglés.
Procedimiento para la toma de datos:
1. En la opción volumen of KIO3 (volumen de KIO3 iodato de potasio) podrás seleccionar el volumen de la solución de ioduro de potasio para cada experimento.
2. Comienza con 10 mL de KIO3 (opción por defecto).
3. Arrastra el matraz Erlenmeyer etiquetado 0,01 M (o mol/L) KIO3 hasta el área de trabajo. Colócalo cerca de la probeta y haz clic sobre la probeta, observarás que se medirá el volumen que has solicitado.
4. Arrastra la probeta hasta el matraz Erlenmeyer de mayor tamaño (donde se llevará a cabo la reacción) y haz clic para descargar el volumen medido.
5. Repite los pasos anteriores con la solución de ácido sulfúrico rotulada 1 M H2SO4.
6. Repite los pasos anteriores para el agua destilada y las siguientes soluciones:
- agua destilada: water.
- solución de almidón: starch.
- solución de sulfito de sodio: 0,005 M sodium sulphite.
7. El cronómetro comenzará a contar el tiempo hasta que se observe una coloración azul. Registra el tiempo final en la tabla que se encuentra a continuación.
* Para comenzar nuevamente el experimento deberás hacer clic en el botón denominado Reset.
8. Repite todos los pasos anteriores seleccionando en volumen of KIO3 9 mL, luego 8 mL, 7 mL y finalmente 6 mL. Recuerda que luego de cada experimento debes hacer clic en reset para comenzar el siguiente.
9. Completa el siguiente cuadro con los resultados obtenidos:
Matraz Erlenmeyer | V KIO3 0,01 mol/L (mL) | 1/V de KIO3 | V H2SO4 1 mol/L (mL) | V H2O (mL) | V solución de almidón (mL) | V Na2SO3 0,005 mol/L (mL) | t de aparición del color azul (min) | t (seg) |
|---|---|---|---|---|---|---|---|---|
| A | 10 | |||||||
| B | 9 | |||||||
| C | 8 | |||||||
| D | 7 | |||||||
| E | 6 |
Para completar la tercera columna (1/V) debes realizar el inverso del volumen de KIO3 dividiendo uno entre el volumen de iodato de potasio (KIO3) empleado en cada experimento.
Análisis de resultados:
Construye una gráfica de tiempo (expresado en segundos) en función del volumen del reactivo KIO3 y otra gráfica del tiempo (expresado en segundos) en función del inverso del volumen de KIO3.
Repasa cómo determinar el orden de una reacción a partir del análisis de cada gráfica en el siguiente enlace.
Preguntas guía:
- ¿Cuál es la variable dependiente, independiente y las variables de control de la actividad?
- ¿Cuál es la pregunta que se quiere responder con la actividad?
Escribe tus respuestas así como la tabla con los datos, el análisis de los resultados y la conclusión a la que llegas en un archivo de texto y súbelo a la tarea como archivo adjunto.