Química - 2º B.D.
¿Qué características presentan los sólidos, líquidos y gases?
2. Interpretación de los estados de agregación utilizando el modelo cinético-corpuscular
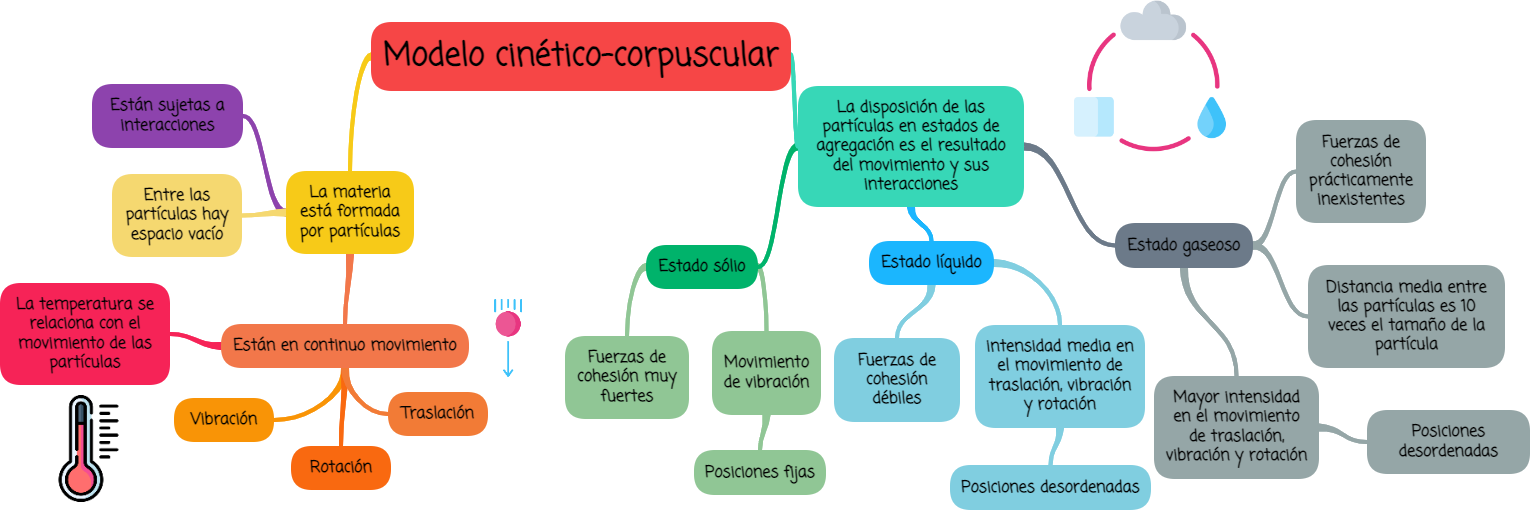
2.1. Modelo cinético-corpuscular
- Toda la materia está formada por partículas y entre ellas el espacio está vacío, es decir, entre ellas no hay nada. Son tan pequeñas que no pueden verse con el microscopio más potente. Son distintas para cada sustancia, diferenciándose en masa y volumen.
- Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. Puede ser de traslación, rotación y vibración. El movimiento tiende a desordenar las partículas y es responsable de la disgregación de la materia. Es decir, cuanto mayor es el movimiento de las partículas su desorden es mayor.
- La temperatura está relacionada con el movimiento intrínseco de las partículas. Cuanto mayor es la temperatura mayor es el movimiento de las partículas.
- Las partículas están sujetas a interacciones o fuerzas de cohesión con otras. Pueden ser fuertes, débiles y extremadamente débiles, prácticamente inexistentes. Las fuerzas de cohesión tienden a ordenar las partículas en determinadas posiciones. Es decir, cuanto mayor son las fuerzas entre las partículas el orden de estas es mayor.
- La disposición de las partículas en sólidos, líquidos y gases es el resultado de su movimiento y de las interacciones.
- El movimiento de las partículas en los gases (movimiento de traslación, rotación y vibración) es de mayor intensidad que en los líquidos (traslación, rotación y vibración) y mucho menor en los sólidos (sólo vibración).
- Las fuerzas de cohesión en los sólidos son fuertes, mucho mayores que en los líquidos, que son débiles, y prácticamente inexistentes en los gases.
- En el caso de los gases las partículas están bastante alejadas en comparación con su tamaño. La distancia media aproximada entre partículas, en condiciones normales, es diez veces el tamaño de la partícula. En el caso de líquidos y sólidos la distancia entre partículas es similar y mucho menor que en los gases, aproximadamente igual de grande que el tamaño de una partícula.
- En los gases las partículas no ocupan posiciones fijas, están desordenadas y se mueven al azar vibrando, rotando y trasladándose en todas direcciones. En los líquidos las partículas tampoco ocupan posiciones fijas, están desordenadas, aunque menos que los gases, y se mueven al azar, igual que en los gases, pero con menor intensidad. En los sólidos las partículas ocupan posiciones fijas, están ordenadas y no tienen movimiento de traslación ni rotación, sólo vibración.