Química - 3º B.D.
Energía y calor
3. ¿Qué es el calor?
3.5. ¿Cómo se calcula el calor?
Se puede determinar el calor que absorbe o libera un sistema conociendo la temperatura inicial y final del sistema, su masa y el calor específico del material que lo forma. El calor se calcula con la siguiente expresión matemática:

Siendo: Q → calor absorbido o liberado por el cuerpo
m → masa del cuerpo
Ce → calor específico (valor característico para cada sustancia o material)
ΔT = Tf - Ti → variación de temperatura (temperatura final menos temperatura inicial)
Para tener en cuenta:
- si el sistema absorbe energía, la temperatura del cuerpo aumenta, es decir la temperatura final es mayor que la inicial, por lo tanto la ΔT es positiva y el Q es positivo: ΔT > 0 → Q > 0.
- si el sistema libera energía, la temperatura del cuerpo disminuye, es decir la temperatura final es menor que la inicial, por lo tanto Δt es negativa y el Q es negativo. ΔT < 0 → Q < 0.
Usando la misma ecuación pero operando matemáticamente se pueden determinar las magnitudes masa, calor específico o variación de temperatura, según se desee y dependiendo de los datos experimentales que se tengan.
El siguiente esquema te puede ayudar a calcular la magnitud que corresponda según los datos, también se aclara la unidad de cada una:
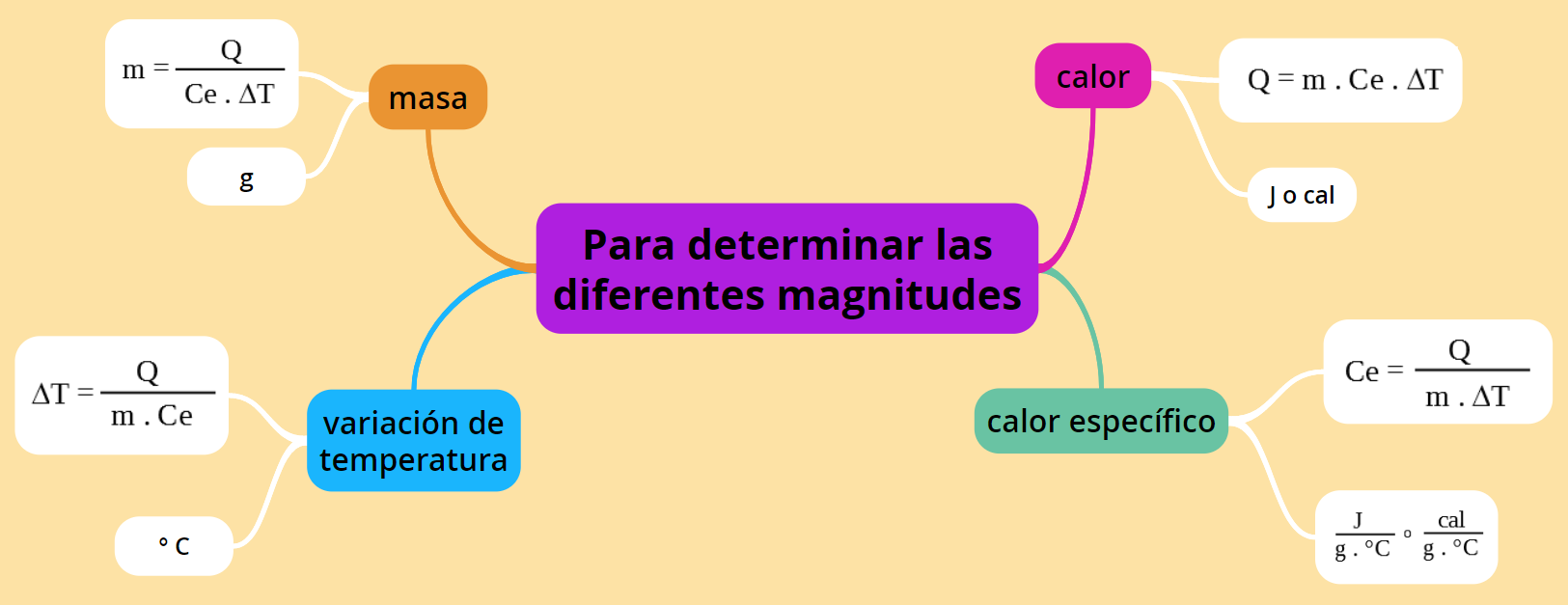
La tabla a continuación contiene la misma información del esquema en otro formato:
Magnitud | Ecuación | Unidades |
|---|---|---|
Calor (Q) | Q = m . Ce . ∆T
| J o cal |
Calor específico (Ce) | Ce = Q/m.∆T
| J/g°C o cal / g°C |
Masa (m) |
m = Q/Ce .∆T | g |
Variación de temperatura (∆T) | ∆T = Q/ m. Ce
| °C |
