Química - 3º B.D.
¿Qué relación hay entre la concentración de los reactivos y la rapidez de una reacción?
4. Comparación gráfica de reacciones de distinto orden
Al construir gráficas de concentración frente al tiempo se obtienen diferentes resultados según el orden global de la reacción.
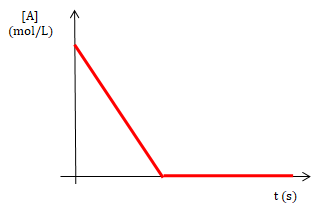
Para una reacción de orden global 0, una gráfica de [A] y tiempo da una línea
recta cuya pendiente es un valor constante (k) y el valor de la
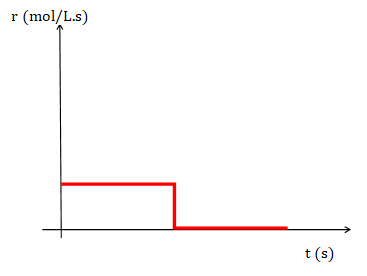
ordenada al origen es [A]0 o concentración inicial del reactivo A. Si se representa la rapidez y el tiempo se obtiene la siguiente gráfica en la que se puede observar que la rapidez es constante y luego pasa a ser 0 cuando todo el reactivo A se ha transformado en producto.
![]()
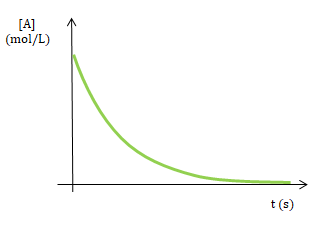
Para una reacción de orden global 1 la rapidez es proporcional a la concentración del reactivo. Como se puede observar al transcurrir el tiempo la concentración del reactivo disminuye.
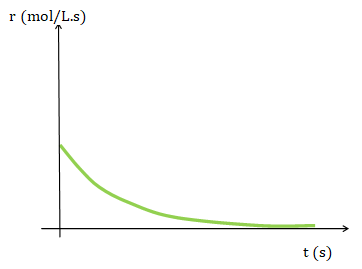
![]()
Para una reacción de orden global 2 la rapidez es proporcional al cuadrado de la concentración y la disminución en la rapidez al avanzar la reacción es mayor que en el caso de una reacción de orden global 1.
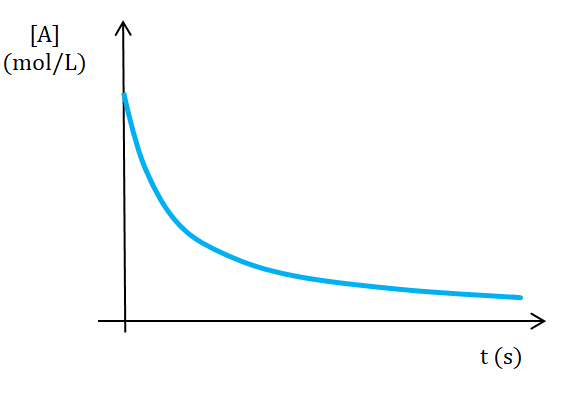
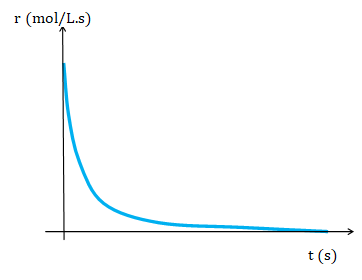
![]()
Al realizar una actividad experimental se suelen obtener datos de concentración al variar el tiempo. ¿Cómo se puede determinar el orden a partir de esos datos?
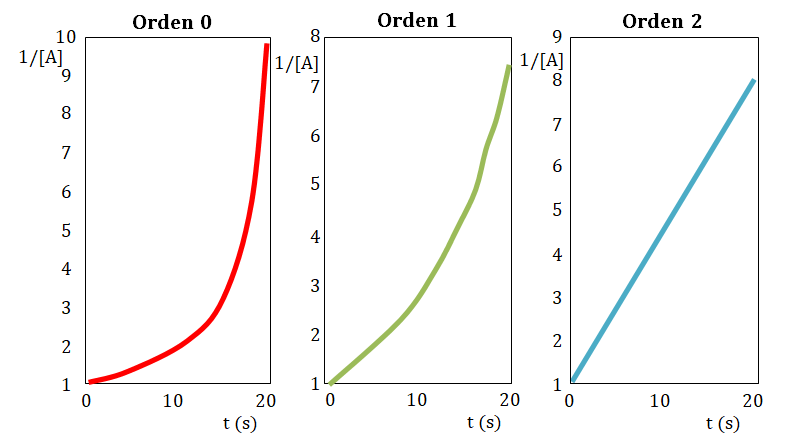
Primeramente construye la gráfica de tiempo en función de la concentración, si la resultante de la misma es una línea recta el orden con respecto al reactivo estudiado es cero.
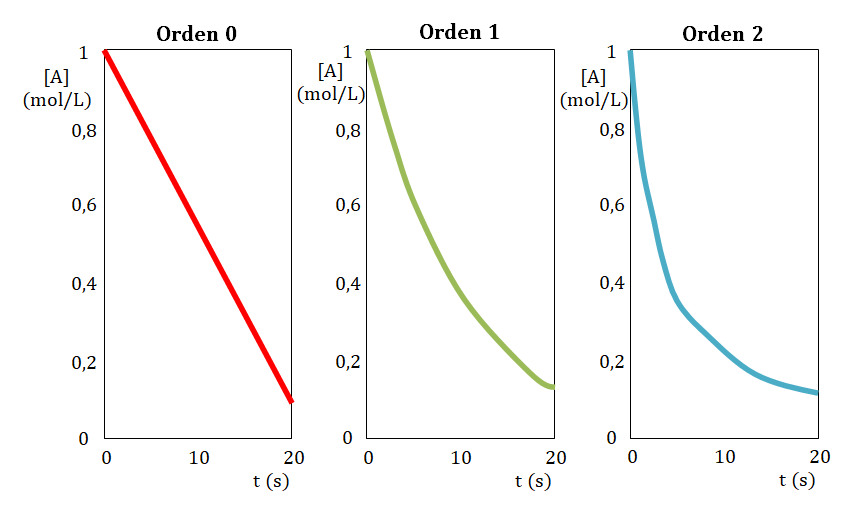
En caso de no obtener una línea recta, construye la gráfica tiempo en función de logaritmo de la concentración, si la resultante de la misma es una línea recta el orden con respecto al reactivo estudiado es uno.
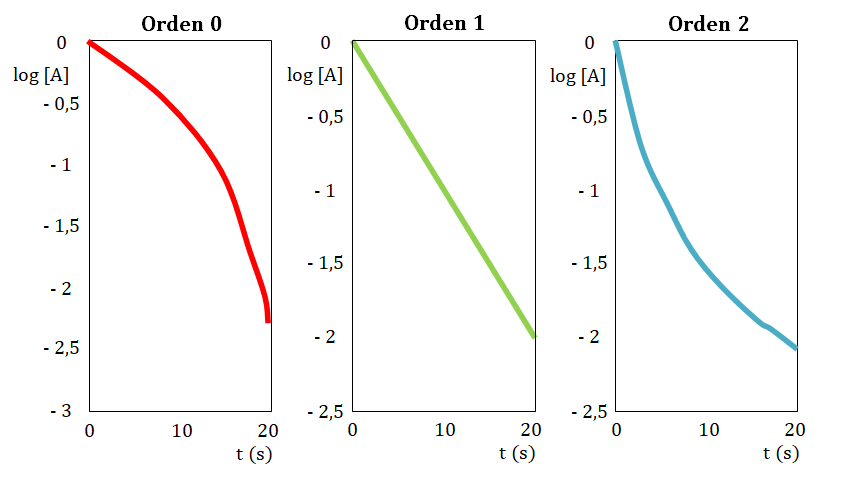
En caso de nuevamente no obtener una línea recta, construye la gráfica tiempo en función del inverso de la concentración, si la resultante de la misma es una línea recta el orden con respecto al reactivo estudiado es dos.