Química - 2º B.D.
Actividad de profundización: El azufre, ¿sólido amorfo o cristalino?
El azufre y sus compuestos ocupan un lugar preeminente entre los productos químicos fundamentales para la industria química, tanto inorgánica como orgánica.
![]()
Conocido desde la antigüedad, se lo menciona en la Biblia y en varios papiros egipcios donde se le adjudicaba propiedades medicinales. Como se encuentra en numerosos lugares de las costas del mar Mediterráneo, no pudo dejar de llamar la atención de los antiguos griegos y romanos. Las erupciones volcánicas arrastraban consigo, invariablemente, enormes cantidades de azufre; y el olor del dióxido de azufre y del sulfuro de hidrógeno se consideraban síntomas de la actividad del dios subterráneo Vulcano. Tanto griegos como romanos quemaban azufre para blanquear telas con los productos de la combustión.

Pintura de Rottmayr del dios Vulcano.
![]()
El azufre desempeñó también un importante papel en las concepciones teóricas de los alquimistas puesto que en aquella época fue considerado como un exponente perfecto de uno de los principios básicos de la Naturaleza: la combustibilidad. Los alquimistas creían que el azufre poseía al mismo tiempo la propiedad enigmática de producir nuevas sustancias al arder, por lo que se lo consideraba como el componente que faltaba para la piedra filosofal, que tan infructuosamente trataban de hallar para poder obtener oro artificial. Fue Lavoisier quien, en 1778, estableció que el azufre es un elemento.

Combustión de azufre. Se observa una llama característica de color azul.
![]()
El azufre se halla muy difundido en la naturaleza y
constituye el 0,03 % de la corteza terrestre. Como sustancia simple se encuentra en las regiones volcánicas
de Islandia, Sicilia, México, Japón y en extensos depósitos subterráneos de Louisiana y Texas.
Los compuestos del azufre son más abundantes que
la sustancia simple. Estos se clasifican en dos grandes grupos: sulfuros y sulfatos. Los sulfuros son compuestos binarios de los elementos con el azufre. Los
sulfuros minerales más importantes son la galena,
PbS, la blenda, ZnS, las piritas de cobre o calcopiritas FeCuS2, el cinabrio, HgS, la estibina Sb2S3, y la pirita FeS2. Entre los sulfatos naturales, los más importantes son el yeso
CaSO4.2H2O, la celestina, SrSO4 y la baritina BaSO4.

Volcán en Sicilia.
![]()
Diversos microorganismos anaerobios reducen el azufre de sus sales y forman sulfuro de
hidrógeno que se acumula en el agua de los yacimientos petrolíferos y en las zonas pantanosas así como en muchos lagos y lagunas donde integran una masa negra y legamosa que
se considera “barro curativo” y se utiliza para fines medicinales.
![]()
El azufre es una materia prima que interviene en un gran número de industrias así como para la fabricación de pólvora. No es de
extrañar, entonces, que con el inicio de la industrialización en Europa comenzara la puja por
el abastecimiento de esa sustancia.
Durante mucho tiempo, el único proveedor de azufre fue Sicilia. La isla se hallaba en manos
de la monarquía italiana y, desde principios del siglo XVIII, las fragatas inglesas bombardearon varias veces las costas sicilianas tratando de adueñarse de esta riqueza. Después los suecos descubrieron
el procedimiento de obtener azufre y ácido sulfúrico de
la pirita. Los enormes yacimientos españoles de piritas
fueron objeto de la atención de varios estados europeos
deseosos de tomar el control de estas fuentes de azufre y
ácido sulfúrico. Los yacimientos sicilianos fueron abandonados y toda la atención se concentró en España hasta que
se descubrió el primer yacimiento, riquísimo, de azufre en
la península de Florida. Era un yacimiento subterráneo,
para la extracción del azufre se diseñó un método novedoso consistente en inyectar en las profundidades vapor de
agua sobrecalentado que, debido a la baja temperatura de
fusión del azufre (119,0 °C), lo fundía bajo tierra, empujándolo en estado líquido hacia la superficie.
Se consiguió construir la primera instalación para la extracción de azufre líquido mediante
bombas aspirantes. El azufre se derramaba sobre el suelo y, al enfriarse, formaba enormes
montículos. Mediante este método se produjeron enormes cantidades de azufre con lo que
los yacimientos españoles e italianos pasaron a segundo plano.

Cristales de azufre en Sicilia
![]()
El azufre sólido, presenta varias modificaciones alotrópicas, las más importantes son el azufre rómbico y el monoclínico, que difieren entre sí por la simetría de los cristales. En la forma rómbica, que es estable en la temperatura ambiente, los átomos de azufre se enlazan formando un anillo octoatómico alabeado o deformado (como se puede observar en el gif que se encuentra a continuación). Por encima de los 95,5 ºC, la forma estable, es el azufre monoclínico que también está compuesto por moléculas de S8. El azufre monoclínico se obtiene cuando se deja enfriar poco a poco el azufre fundido. Cuando este se deja a temperatura ambiente, los cristales transparentes se vuelven opacos al pasar a la variedad rómbica, convirtiéndose en agregados en forma de agujas de cristales microscópicos del azufre rómbico.
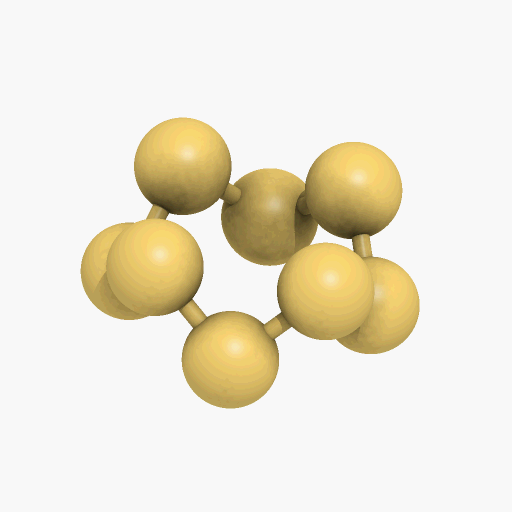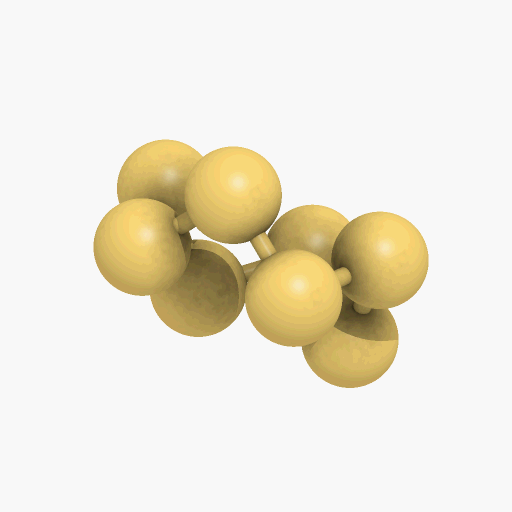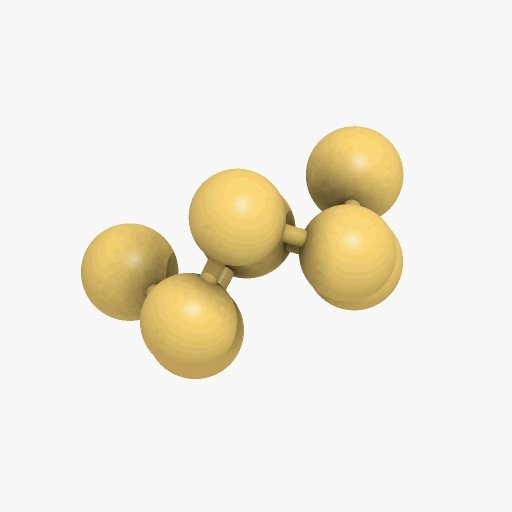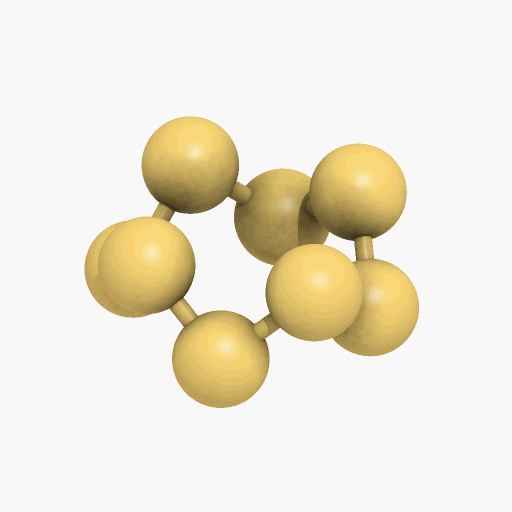
Un diagrama de fases es un mapa que muestra cuál fase es la más estable a diferentes presiones y temperaturas. Como el azufre tiene dos fases sólidas, rómbica y monoclínica, correspondiente a las dos maneras en las cuales sus moléculas S8 con forma de corona pueden apilarse juntas. Las líneas que separan las regiones en el diagrama se denominan límites de fase, en cualquier punto sobre un límite entre dos regiones, las dos fases vecinas coexisten en equilibrio dinámico.
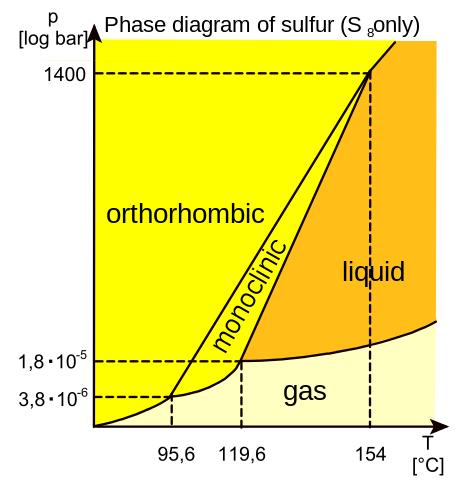
Diagrama de fases del azufre
El azufre líquido, a temperatura cercana al punto de fusión de la forma monoclínica, 119,0 ºC, es un líquido móvil de color amarillo. Si se lo calienta, se va espesando gradualmente, siendo máxima su viscosidad entre los 165,0 y los 200,0 ºC. Si se continua el calentamiento, el líquido se vuelve cada vez más fluido, hasta alcanzar el punto de ebullición a los 444,6 ºC. Si en su estado más viscoso (que puede tomar un color rojo oscuro cuando contiene impurezas) se vierte en agua, se forma el azufre amorfo o plástico. Este alótropo está compuesto por largas cadenas de átomos de azufre.
- Indica 3 ejemplos de sustancias compuestas citadas en el texto formadas por el elemento azufre.
- ¿Qué usos se daban al azufre en el pasado?
- ¿Qué propiedad le atribuían los alquimistas al azufre? Escribe una ecuación química que la represente.
- ¿Qué usos se le da actualmente al azufre? ¿Conoces algún uso cotidiano del mismo? Si así es, ¿cuál?
- La formación de la lluvia ácida fue estudiada en el siglo XIX por un farmacéutico de Manchester llamado Robert Angus Smith, que midió la alta acidez del agua de lluvia que caía sobre las regiones industriales de Inglaterra y las contrastó con los niveles más bajos de acidez encontrados en zonas menos contaminadas de la costa inglesa. Este científico publicó en 1852 un informe detallado sobre la variación de la composición química del agua de lluvia con las distancias al centro de la ciudad de Manchester. En 1863, Smith fue el primer “Alkali Inspector” de Manchester (oficial público encargado de monitorear la polución ambiental). En 1872 publicó “Air and Rain: The Beginnings of Chemical Climatology” donde acuñó el término “lluvia ácida”.
- ¿Qué relación tiene la lluvia ácida con el tema de esta actividad?
- ¿Cuál es la situación en nuestro país al respecto?
- ¿Cuál es el pH de la lluvia comúnmente?
- ¿A qué se debe que la lluvia se acidifique? Escribe una ecuación química que lo represente.
- ¿Qué método se puede emplear para la extracción del azufre?
- Observa el siguiente video y tomando en cuenta el material analizado indica qué está ocurriendo.
- El video que se encuentra a continuación muestra un procedimiento que se puede llevar a cabo para obtener cristales rómbicos de azufre. El video se encuentra en inglés por lo que te sugerimos que actives los subtítulos y los traduzcas automáticamente a español (puedes repasar cómo hacerlo en el siguiente enlace). Luego de observarlo contesta las preguntas finales.
- ¿Qué procedimiento se lleva a cabo?
- ¿Cuál es el solvente empleado y qué medidas de seguridad se deben tomar en cuenta para trabajar con el mismo? Busca la ficha de datos de seguridad química para complementar tu respuesta.
- ¿Cómo explicas que se sugiera una evaporación lenta para obtener los cristales?
- ¿Qué diferencias a nivel corpuscular hay entre el azufre cristalino y el amorfo?
- ¿Qué diferencias macroscópicas se observan entre cristales de azufre rómbicos o monoclínicos?
- El próximo video ejemplifica cómo se pueden obtener cristales monoclínicos de azufre. Recuerda activar los subtítulos en español.
- ¿Cuál es el procedimiento seguido?
- ¿Por qué el calentamiento que se realiza debe ser suave?
- Como medidas de seguridad se debe realizar la actividad bajo campana o en un ambiente ventilado, además evitar que los vapores liberados se enciendan observándose una llama azul. ¿Qué relación guarda esta sugerencia con lo trabajado en el texto?
- ¿Qué crees que se busca lograr al perforar la costra o nata que se forma al momento del enfriamiento y se vierte parte del líquido que se encuentra por debajo?
- ¿Qué relación tiene este experimento con el diagrama de fases del azufre?
- ¿Por qué no son sinónimos entre sí un cambio de fase y un cambio de estado de agregación?
- Si se observa la muestra luego de pasar unos días el azufre vuelve a presentar cristales rómbicos. ¿Cómo lo explicas utilizando el diagrama de fases?
Sube tus respuestas en un archivo adjunto.
