Química - 3º B.D.
¿Qué son las proteínas? ¿Qué funciones cumplen? ¿Qué niveles presentan?
3. Estructura de las proteínas
3.1. Nivel secundario
ESTRUCTURA SECUNDARIA: La estructura secundaria de las proteínas es el plegamiento que la cadena polipeptídica adopta gracias a la formación de enlaces o puentes de hidrógeno entre los átomos que forman el enlace peptídico. Los enlaces de hidrógeno se establecen entre los grupos -CO- y -NH- del enlace peptídico (el primero como aceptor de H, y el segundo como donador de H). De esta forma, la cadena polipeptídica es capaz de adoptar conformaciones de menor energía libre, y por tanto, más estables.
Son ejemplos las α–hélice y las láminas β, y también tipo colágeno (tres cadenas peptídicas retorcidas entre sí formando como un cordón).
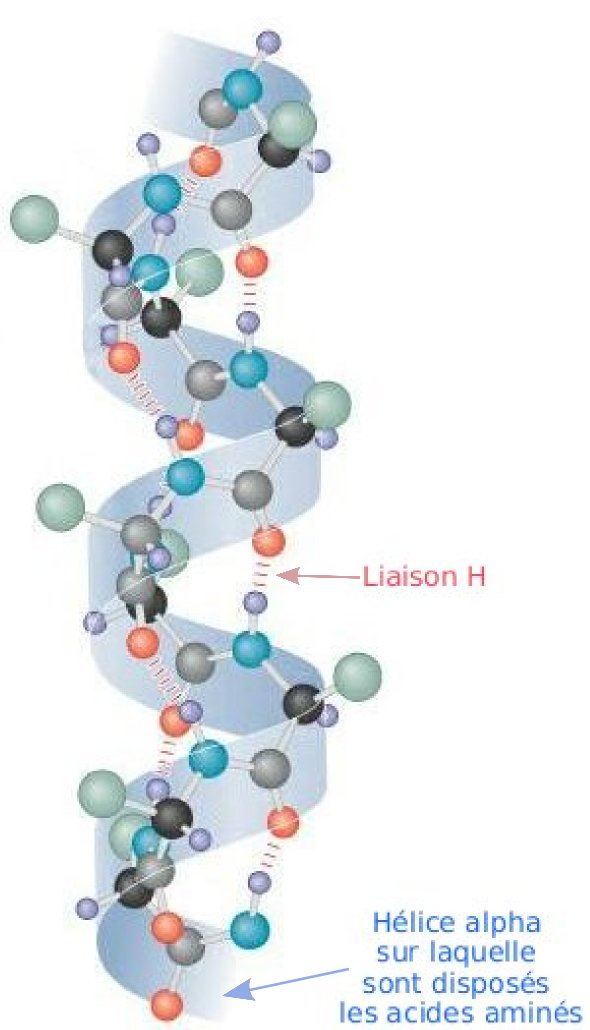
Alfa hélice: Esta estructura se mantiene gracias a los enlaces de hidrógeno intracatenarios formados entre el grupo -NH de un enlace peptídico y el grupo -C=O del cuarto aminoácido que le sigue. La cadena polipeptídica se enrolla en espiral sobre sí misma debido a los giros producidos en torno al carbono alfa de cada aminoácido. Las cadenas laterales de los aminoácidos se sitúan en la parte externa del helicoide, lo que evita problemas de impedimentos estéricos. En consecuencia, esta estructura puede albergar a cualquier aminoácido, a excepción de la prolina, cuyo carbono no tiene libertad de giro, por estar integrado en un heterociclo. Por este motivo, la prolina suele determinar una interrupción en la conformación en α-hélice. Los aminoácidos muy polares (Lys, Glu) también desestabilizan la hélice porque los enlaces de hidrógeno pierden importancia frente a las interacciones electrostáticas de atracción o repulsión.
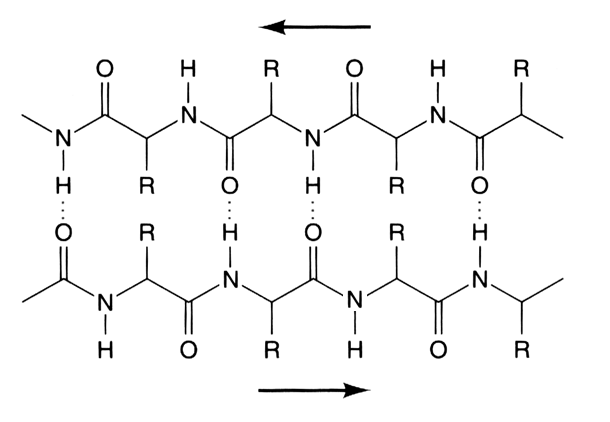
Láminas beta: Cuando la cadena principal de un polipéptido se estira al máximo que permiten sus enlaces covalentes se adopta una configuración espacial denominada estructura β, que suele representarse como una flecha. En esta estructura las cadenas laterales de los aminoácidos se sitúan de forma alternante a la derecha y a la izquierda del esqueleto de la cadena polipeptídica. Las estructuras β de distintas cadenas polipeptídicas o bien las estructuras β de distintas zonas de una misma cadena polipeptídica pueden interaccionar entre sí mediante puentes de hidrógeno, dando lugar a estructuras laminares llamadas por su forma hojas plegadas u hojas β. Cuando las estructuras β tienen el mismo sentido, la hoja β resultante es paralela, y si las estructuras β tienen sentidos opuestos, la hoja plegada resultante es antiparalela.
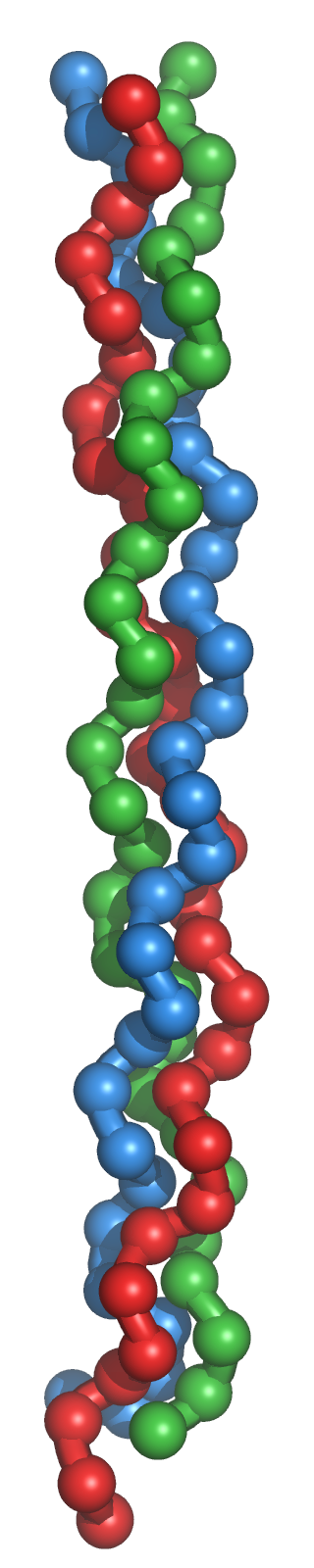
Tipo colágeno: Es una variedad particular de la estructura secundaria, característica del colágeno. El colágeno es una importante proteína fibrosa presente en tendones y tejido conectivo con función estructural ya que es particularmente rígida. Presenta una secuencia típica compuesta por la repetición periódica de grupos de tres aminoácidos. El primer aminoácido de cada grupo es Gly, y los otros dos son Pro (o hidroxiprolina) y un aminoácido cualquiera: -(G-P-X)-. La frecuencia periódica de la Prolina condiciona el enrollamiento peculiar del colágeno en forma de hélice levógira. La glicina, sin cadena lateral, permite la aproximación entre distintas hélices, de forma que tres hélices levógiras se asocian para formar un helicoide dextrógiro.
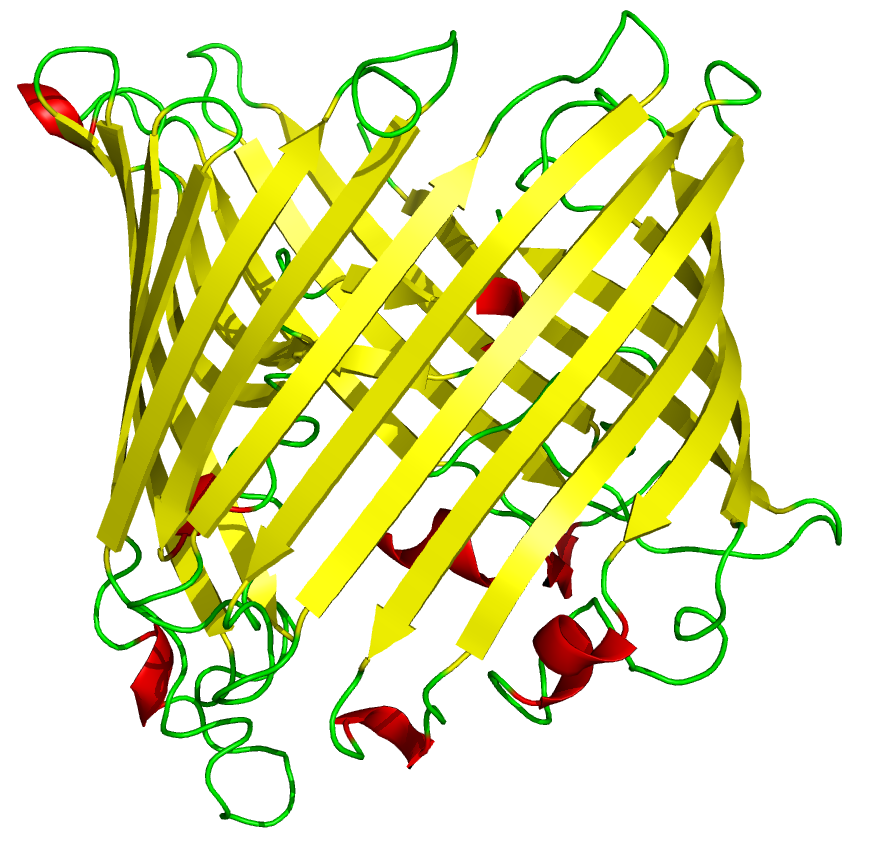
PARA TENER EN CUENTA: A pesar que las proteínas fibrosas tienen un solo tipo de estructura secundaria, las proteínas globulares pueden presentar varios tipos de estructura secundaria en la misma molécula.
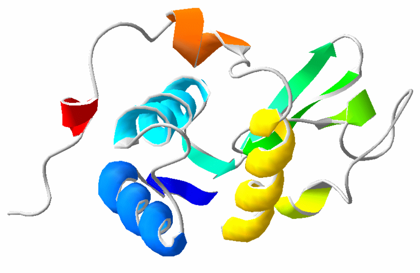
La unión entre los tipos de estructuras secundarias se llaman bucles (2 a 16 aa) y si son muy cortos giros (2 a 3 aa).
